1. 서 론
2. 실험 및 수치해석 방법
2.1 화염의 RSIB 이론
2.2 실험방법
2.3 수치해석
3. 결과 및 고찰
3.1 메카니즘 검증
3.2 신장률과 에 따른 소화거동 특성
3.3 화염의 구조
4. 결 론
기 호 설 명
: Global strain rate (s-1)
: Local strain rate (s-1)
: Volume fraction rate of H2
: Thermal diffusivity (cm2/s)
: Mass diffusivity (cm2/s)
Le : Lewis number
LeD : Deficiant lewis number
𝛼 : Cracking ratio
: Flame thickness (cm)
sL : Laminar burning velocity (cm/s)
: Flame time (s)
: Resilience to strain-induced blow-out
1. 서 론
최근 지구 온난화 및 기후 변화 등 심각한 환경 문제로 인하여 전세계적으로 이를 극복하기 위한 노력들이 지속적으로 이루어지고 있다. 이에 따라 탄소를 배출하지 않는 무탄소 연료를 이용하여 이산화 탄소 배출을 저감 할 수 있는 연소기술 및 연소기 개발에 대한 연구의 필요성이 커지고 있다. 대표적인 무탄소 연료로는 수소(H2)와 암모니아(NH3)가 있다. 수소는 다른 연료에 비해 질량 대비 에너지 밀도가 높으며, 가연 한계가 넓고 연소속도가 빠른 특징을 가진다. 이러한 특징을 가진 수소는 무탄소 연료로써 각광받아 많은 연구에서 활용되고 있다[1,2]. 그러나 수소는 빠른 연소속도와 낮은 자발화 온도로 인해 폭발의 위험성이 크고, 수소 에너지를 운반하는데 있어서 낮은 액화 온도로 인해 에너지원 저장에 있어 기술적, 경제적으로 어려움이 존재한다.
이에 비해 암모니아는 대기압 조건에서 액화 온도가 -33℃로 상온에서의 기화 압력을 가하면 액화가 가능하여 저장 및 운반에 용이하다는 특징이 있다. 또한 암모니아는 질량 기준으로 17.8%의 수소를 포함하고 있어 수소 에너지원의 캐리어로써 활용이 가능하다[3]. 그러나 암모니아는 단일 연료로써 낮은 가연한계와 높은 자발화 온도로 인해 연소 성능이 떨어지며, 암모니아에는 질소(N) 성분이 포함 되어있어 연소 시 질소산화물(NOx) 배출에 대하여 자유롭지 못한 점이 있다. 이러한 암모니아의 낮은 연소성능을 보완하기 위해 메탄이나 수소 등을 혼합하여 연소시키는 방법이 고려된다[4,5,6,7,8]. 최근에는 암모니아에 열을 가하여 질소와 수소로 분해하는 크래킹 공정을 통해 수소를 친환경적으로 생산하는 방식이 각광을 받고 있다[9,10,11,12]. 암모니아는 열분해를 통해 수소와 질소를 생산할 수 있는데(2NH3→N2+3H2), 촉매 반응을 통하거나, 촉매 반응 없이 500℃ 이상의 열분해 환경에서 98%의 전환 효율을 가진다[13,14].
암모니아 부분 크래킹을 통해 얻은 혼합 연료, 특히 43%의 암모니아 크래킹 연료는 기존의 LNG 연료와 비슷한 연소 특성을 가진다고 보고 되는 등 부분 크래킹 된 암모니아 연료에 대한 기초연소 특성에 대한 연구가 활발히 진행되고 있다[13,15]. 스월 안정화 화염을 통해 암모니아 부분 크래킹 연료에 대해 크래킹 비율에 따른 가연한계에 대한 연구를 수행한 결과, 크래킹 비율이 28%인 경우에 희박 안정화 경계를 향상시킨다는 것으로 보고하고 있다[16]. 또한 암모니아를 43% 크래킹 시 혼합연료 NH3 40%/H2 45%/N2 15%-air 예혼합 화염은 CH4-air 예혼합 화염과 스트레치 되지 않은 층류 화염의 특성 및 층류연소속도가 매우 유사한 특징을 가지며, CH4-air 예혼합 화염에 비해 희박 조건에서 화염의 스트레치로 인한 화염 날림(소화거동)에 대한 저항성이 상당하게 증가하는 것으로 보고되고 있다[17]. 한편 부분 크래킹된 암모니아 연료의 소화신장률에 대한 대향류 화염 연구에서 스트레치로 야기된 화염의 소화에 대한 저항성을 나타내는 무차원수 물리량인 RSIB(Resilience to strain-induced blow-out)를 도입하여 순수 메탄 100%인 CH4-air 예혼합화염과 비교를 하였다. 그 결과 희박조건에서 부분 크래킹 모사 연료가 CH4-air 예혼합화염에 비해 높은 RSIB를 가지며, 부분 크래킹으로 수소비율이 H2 21% ~ 33%(크래킹비 16% ~ 28%) 범위에서 연소로 야기된 화염 스트레치에 저항하여 가장 높은 RSIB 값을 가진다는 결과를 보고하였다[18].
이처럼 아직까지 암모니아 부분크래킹 연료의 소화거동에 관한 연구는 미비한 실정이다. 이에 본 연구팀에서는 부분 크래킹 공정을 통해 얻게되는 암모니아, 수소, 질소 혼합물 연료를 모사하여 상호작용하는 대향류 예혼합화염에서 소화거동 특성과 화학적 상호작용 메커니즘에 대한 연구를 수행하였다.
2. 실험 및 수치해석 방법
2.1 화염의 RSIB 이론
RSIB(Resilience to strain-induced blow-out)는 화염의 스트레치로 인한 소화에 대한 저항성을 정의하는 개념으로 화염의 시간(flame time, tF)과 소화신장률(extinction strain rate, )을 곱한 무차원수로 식 (1)과 같이 정의할 수 있다.
식 (1)에서 는 화염의 시간을 나타낸다. 화염의 시간은 화염의 온도, 층류 연소 속도(laminar burning velocity, sL), 화염면(flame front)의 두께(flame thickness, )의 관계식으로 정의할 수 있으며[18,19], 다음 식 (2)와 같이 나타낼 수 있다.
식 (2)에서 Tb, Tu는 각각 화염의 온도와 미연혼합기의 온도를 나타내고, 는 축방향 거리를 나타낸다. 소화신장률 는 화염이 소화하기 직전의 로컬신장률(local strain rate, )을 나타내며 축방향 거리에 대한 유속 변화율의 최대값으로 식 (3)과 같이 정의할 수 있다.
식 (3)에서 는 축방향 유속을 나타낸다.
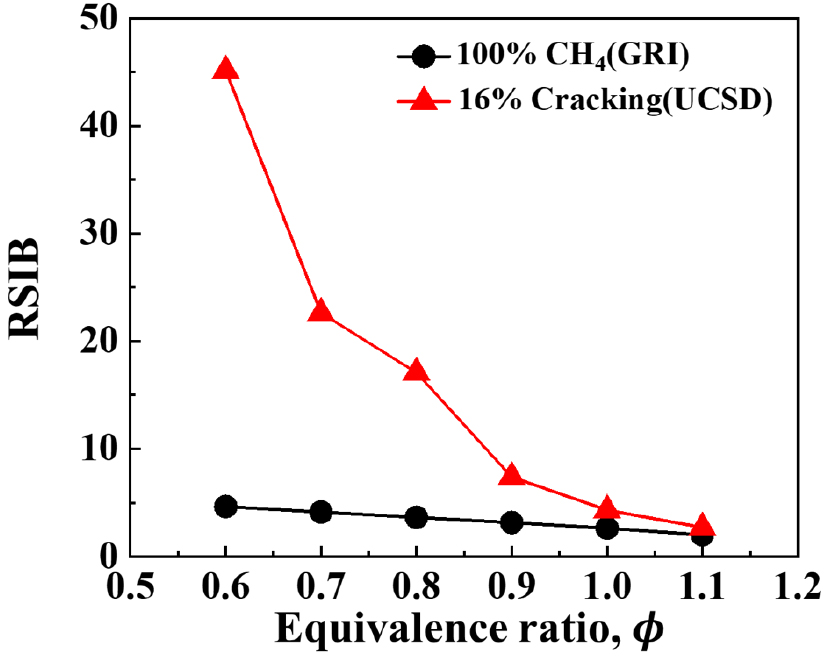
Fig. 1은 RSIB 값을 결정짓는 변수인 화염의 시간과 소화신장률을 당량비에 따라 100% CH4과 16% 크래킹 된 암모니아 연료 조건에서 나타낸 그래프이고, Fig. 1은 CH4과 16% 크래킹 된 암모니아의 RSIB 값을 당량비에 따라 나타낸 그래프이다. 이 경우 화염의 로컬신장률은 OPPDIF코드, 화염의 시간은 PREMIX 코드를 이용하여 계산하였다. CH4는 GRI 3.0 메카니즘을 이용하였고, 16% 크래킹 된 암모니아는 3.1절에서 메카니즘 검증을 수행한 뒤 UCSD 메카니즘을 이용하여 계산하였다. Fig. 3에서 16% 크래킹 시 소화 신장률은 ϕ = 0.6을 제외하고, CH4가 16% 크래킹 된 암모니아보다 높은 값을 가진다. 반면 화염의 시간은 CH4에 비해 16% 크래킹 된 암모니아가 높은 값을 가진다.
Fig. 2에서 이 2개 변수들의 곱으로 표현되는 RSIB는 16% 크래킹 된 암모니아가 더 높은 값을 갖는다. 당량비가 낮을수록 RSIB 값의 격차는 더 벌어지며, 특히 ϕ = 0.6일 때 16% 크래킹된 암모니아의 RSIB가 CH4의 RSIB의 10배 이상의 값을 갖는 것을 알 수 있다. 이러한 결과는 선행 연구[18]의 RSIB 결과와 거의 일치한다. 선행 연구[18]에서도 암모니아 크래킹 비율이 높아지면서 RSIB는 증가하다가, 어느 일정 크래킹 비율 이후에 다시 감소하는 경향을 보이는 것으로 보고 하고 있다. RSIB는 크래킹 비율 16~28% 구간에서 가장 높은 값을 가지며, 본 연구에서는 암모니아 크래킹 시 필요한 에너지를 최소화 하면서 높은 RSIB 값을 가지는 16% 크래킹 비율의 연료에 대하여 연구를 수행하였다.
2.2 실험방법
암모니아는 크래킹을 통해 2몰의 암모니아가 3몰의 수소와 1몰의 질소로 분해된다(2NH3→N2+3H2). 암모니아의 크래킹 비율(cracking ratio, 𝛼)은 식 (4)와 같이 정의할 수 있다[15].
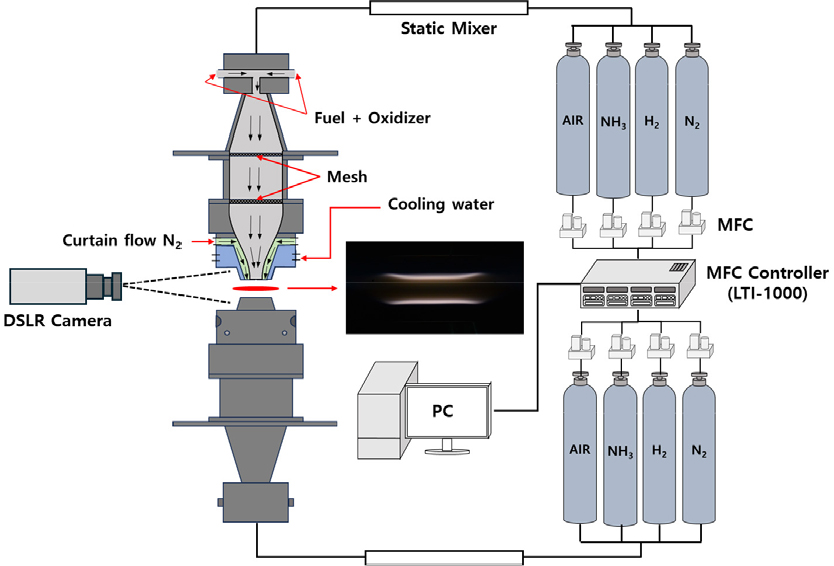
는 혼합연료 내 화학종 i의 질량분률이다. 본 연구에서 NH3/H2/N2를 체적분률 기준으로 0.72/0.21/0.07 비율의 혼합 연료(16% 크래킹)를 모사하여 사용하였다. 본 연구인 암모니아 크래킹 연료의 화염 간 상호작용에 의한 소화거동을 관찰하기 위한 이중 대향류 실험장치를 Fig. 3에 도시하였다. 상하부 노즐 유로계 내부에는 메쉬를 설치하여 혼합 유체가 균일하게 공급이 되도록 하였다. 노즐 출구까지 36의 교축비를 가지는 헬름홀츠 공명기의 원리를 적용한 구조로 이루어져 있어, 혼합기의 유동에서 발생하는 소음과 진동을 차단하도록 하였다. 상하부 노즐 간의 거리는 12 mm이고, 노즐의 직경은 10 mm이다. 메인 노즐 주변에는 외부 유동장에 의한 화염의 교란을 억제하기 위하여 20 mm 직경의 질소 커튼 노즐을 구성하였다. 질소 커튼 유동장 내의 질소 유속은 노즐에서 나오는 혼합 유체의 유속과 동일하게 조절하였다. 연료 및 산화제는 상하부에서 스태틱 믹서를 통과하여 예혼합 되어 연소기에 공급된다. 연료 및 산화제는 MFC와 MFC 컨트롤러를 이용하여 체적유량을 정밀하게 조절하며 공급하였다. 화염의 거시적인 이미지는 DSLR을 이용하여 셔터 속도, F값, ISO 값을 고정하여 촬영 하였다. 취득된 화염의 이미지는 화염 간의 거리와 화염의 세기를 측정하여 화염 간의 소화거동을 관찰하는데 사용되었다.
2.3 수치해석
수치해석은 Chemkin pro의 OPPDIF-code를 사용하여 진행하였다. OPPDIF 코드는 Kee 등[20]에 의해 개발되고, Lutz[20]에 의하여 확장되었으며, 정체면을 기준으로 1차원 상사성 모델을 적용하여 수학적으로 해석하기 용이하다. 수치해석 시 분위기 조건은 1 atm, 298 K로 고정하였고, 노즐 간의 간격은 12 mm로 고정하였다. 화염 간의 복잡한 화학적 상호작용 현상을 해석하기 위하여 격자(grid)는 600개 이상을 사용하였다.
대향류 화염을 해석하는데 있어 화염 간의 상호작용에 영향을 끼치는 주요한 변수로 화염의 전체 신장률(global strain rate)과 수소의 체적분률(volume fraction of H2)이 있으며, 각각 다음과 같은 식으로 정의된다.
식 (5)에서 L은 두 노즐간의 거리이고, V, 𝜌는 각각 노즐에서 분사되는 혼합물의 축 방향 속도(axial velocity)와 밀도를 나타낸다. 하첨자 1, 2는 각각 상부와 하부의 노즐을 의미한다. 신장률 식은 상부 하부의 노즐에서 모멘텀 보존 방정식( )을 고려하여 로 정의하였다. 식 (6)에서 수소의 체적분률은 연료, 산화제 전체 몰분률의 합에 대한 수소의 몰분률의 비로 정의한다. 본 연구에서 실험과 수치해석에서 사용된 변수를 Table 1에 정리하여 나타내었다.
3. 결과 및 고찰
3.1 메카니즘 검증
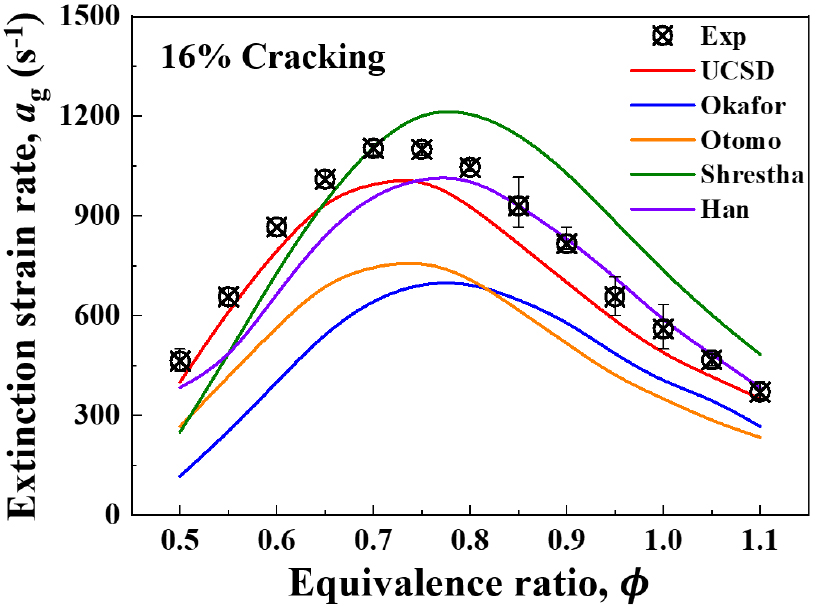
수치해석 시 실제 대향류 화염의 소화거동 및 상호작용을 근접하게 모사하기 위하여 실제 실험을 통해 얻은 소화경계와 5개의 화학적 메커니즘으로 계산한 소화경계를 비교하여 메커니즘 검증을 실시하였다. 수치해석은 UCSD[21], Okafor[22], Otomo[23], Shrestha[24], Han[25] 총 5개 반응기구들을 사용하여 비교하였다.
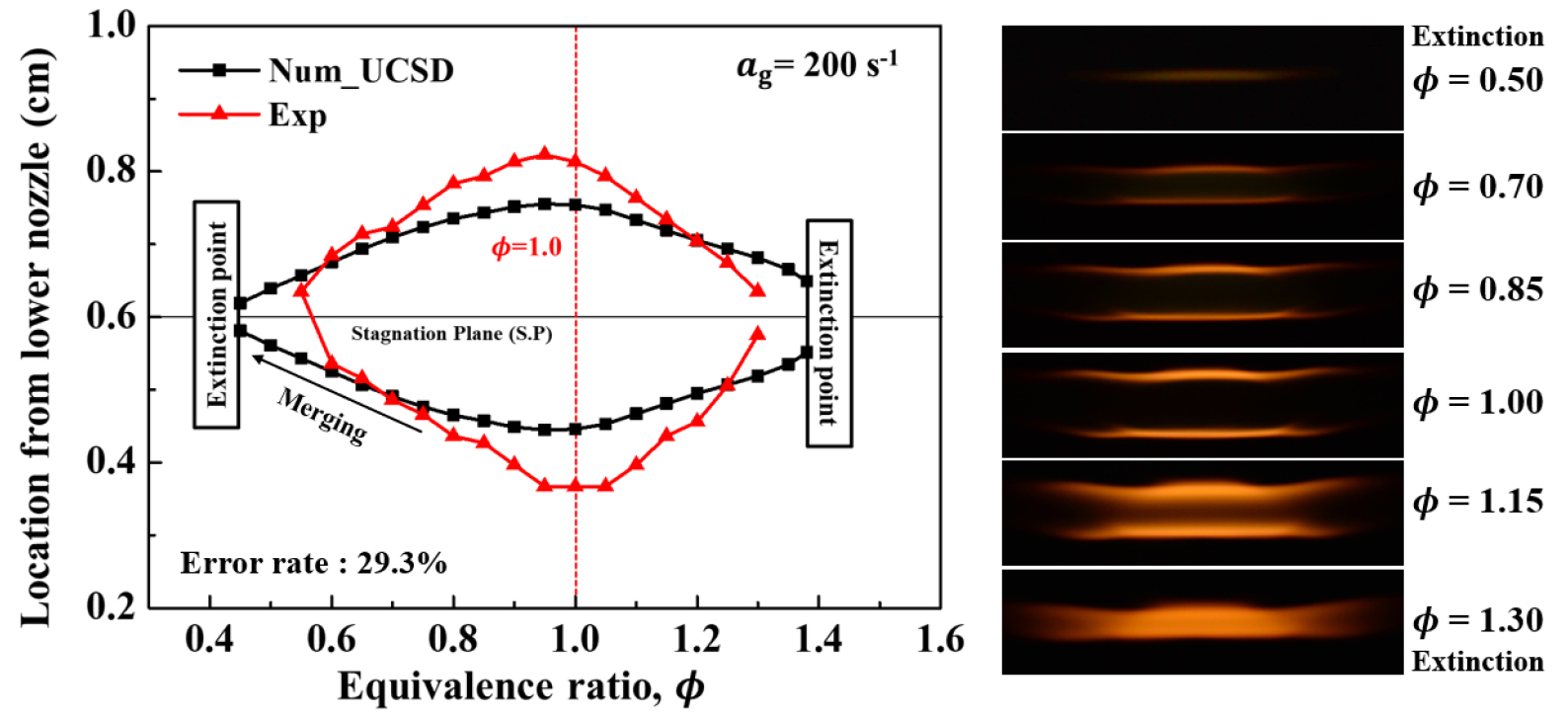
Fig. 4에 실험적 소화경계와 수치해석으로 계산한 소화경계를 비교한 결과를 그래프로 나타내었다. Otomo, Okafor 메커니즘은 실험적 소화경계와 상당한 차이를 보이며 실험적 소화경계를 전혀 모사를 못하는 것을 알 수 있다. Shrestha는 당량비 0.7 이전까지 실험값과 비슷한 경향 을 따라가지만 당량비 0.7 이후부터 차이가 점점 벌어져 실험적 소화경계와의 차이를 보인다. Han과 UCSD는 실험적 소화경계와 상당히 근접한 것을 알 수 있다. 당량비 0.5~0.7 구간까지는 UCSD 메커니즘과 가장 잘 일치하며 당량비 0.7~1.1 구간에서는 Han 메커니즘이 더 근접하게 모사하는 것을 알 수 있다. 당량비 0.5~1.1 구간에서 실험에 대한 소화경계의 오차율은 UCSD, Han 메커니즘에서 각각 9.89%, 10.06%이며, 전체적으로 UCSD가 더 낮은 값을 가진다. 이후 수치해석은 UCSD 메커니즘을 이용하여 진행하였다.
3.2 신장률과 에 따른 소화거동 특성
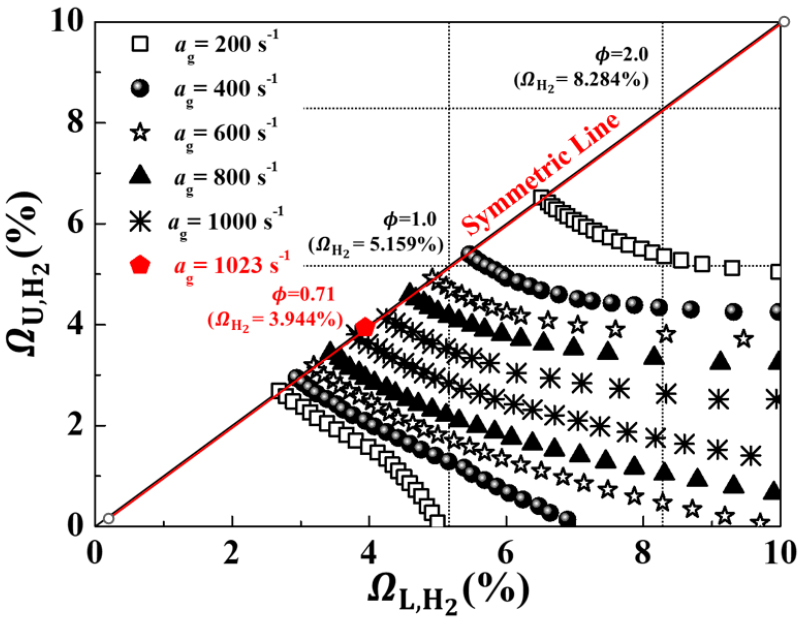
Fig. 5에서 상부 및 하부 노즐의 수소 몰분률, 전체 신장률에 따른 화염의 소화경계에 대한 안정화선도를 나타낸 그림이다. Fig. 5에서 소화경계를 보면 신장률 200 s-1 조건에서 신장률이 낮은 조건에서는 넓은 가연한계를 가지며 신장률 증가에 따라 화염의 소화경계는 좁아진다. 계속 신장률이 증가하여 1023 s-1에 이르러서 수소 몰분률이 3.94%인 지점에서만 생존하게 된다. 이때의 당량비는 0.71이며, 약간 희박한 구간에서 화염이 신장률에 대한 저항성이 가장 강한 것을 알 수 있다. 화염의 소화경계가 나타내는 기울기는 화염 간의 상호작용을 의미한다고 보고 된 바 있다[26]. 희박 소화경계 조건(lean extinction oundary, LEB)과 과농 소화경계 조건(rich extinction boundary, REB)의 소화경계의 기울기는 서로 다른 경향을 보이는데, 희박 구간에서는 소화경계의 기울기가 과농 구간보다 가파르며, 가 낮아지면서 소화경계는 더 급격하게 기울어진다. 이는 약한 상부화염이 생존 불가능한 구간에서 강한 하부화염 간의 상호작용으로 인하여 화염이 생존하는 것을 의미한다. = 200 s-1일 때 희박 가연한계가 대칭화염 조건에서는 = =2.68%이고, 하부화염만 생존할 때 =5.002%, =0%로 나타난다. 신장률이 증가하면서 대칭화염과 단일 화염조건에서의 가연한계는 더 큰 차이로 벌어지며 이는 화염 간의 상호작용이 더욱 증가한다는 것을 의미한다. 이와 다르게, 과농 소화경계 조건에서는 기울기가 완만하며, 두 화염 간의 상호작용은 희박 소화경계 조건에 비해 약하게 나타나며, 신장률이 증가해도 소화경계의 기울기 변화가 거의 없어 화염 간의 상호작용에 관하여 신장률에 따른 긍정적인 영향을 받지 않는 것으로 볼 수 있다. 이러한 차이는 열 확산도(thermal diffusivity, 𝛼)와 질량 확산도(mass diffusivity, )의 비로 정의되는 루이스 수(Lewis number, Le)로 설명할 수 있다. 희박 구간에 해당하는 Le < 1 조건의 경우 신장률이 증가하면서 반응률이 증가하다가 다시 감소하며 소화하는 경향을 보이고, 과농 구간에 해당하는 Le > 1 조건의 경우 신장률이 증가하면서 반응률이 계속 감소하다가 소화하는 경향을 보인다[27].
다음으로 실험과 수치해석을 통해 구한 희박 소화경계부터 과농 소화경계까지의 화염대 위치를 Fig. 6에 도시하였다. 신장률 = 200 s-1 조건에서 실험과 수치해석을 진행했으며, 화염대의 위치는 수치해석을 통해 열방출률(heat release rate)이 최대인 지점으로 정의하였다. 오른쪽에는 희박 소화경계 조건부터 과농 소화경계 조건까지의 화염 거동을 보여주며, 실험을 통해 화염의 직접 이미지를 촬영하고, Matlab을 이용하여 이미지 변환 후 0~255의 임계값을 취득하여 최대 강도 지점을 화염대로 정의하였다. 두 화염 간의 거리는 당량비 1에 가까워지면서 연소속도가 높아지면서 멀어지는 것을 볼 수 있다. 그리고 희박, 과농 조건 모두 소화경계 조건에 이르면서 화염 간의 거리가 가까워져 소화하게 된다. 희박 소화경계 조건에서는 정체점에서 화염이 병합하는 현상이 발생하면서 소화하고, 과농 소화경계 조건에서는 화염이 정체점으로부터 어느정도 거리가 떨어져 있는 상태에서 소화하는 것을 수치해석과 실험결과를 통해 알 수 있었다. 희박 소화경계 조건에서는 Le < 1이므로 열 확산률에 비해 질량 확산률의 영향이 크므로 화염 간의 거리가 가까워져 신장률이 증가하면서 화염의 활성기들 간의 공유가 증가하여 상호작용이 강해진다. 반대로 과농 소화경계 조건에서는 Le > 1이므로 질량 확산률보다 열 확산률의 값이 커 화염 간의 거리가 멀어 상호작용이 잘 일어나지 않는다.
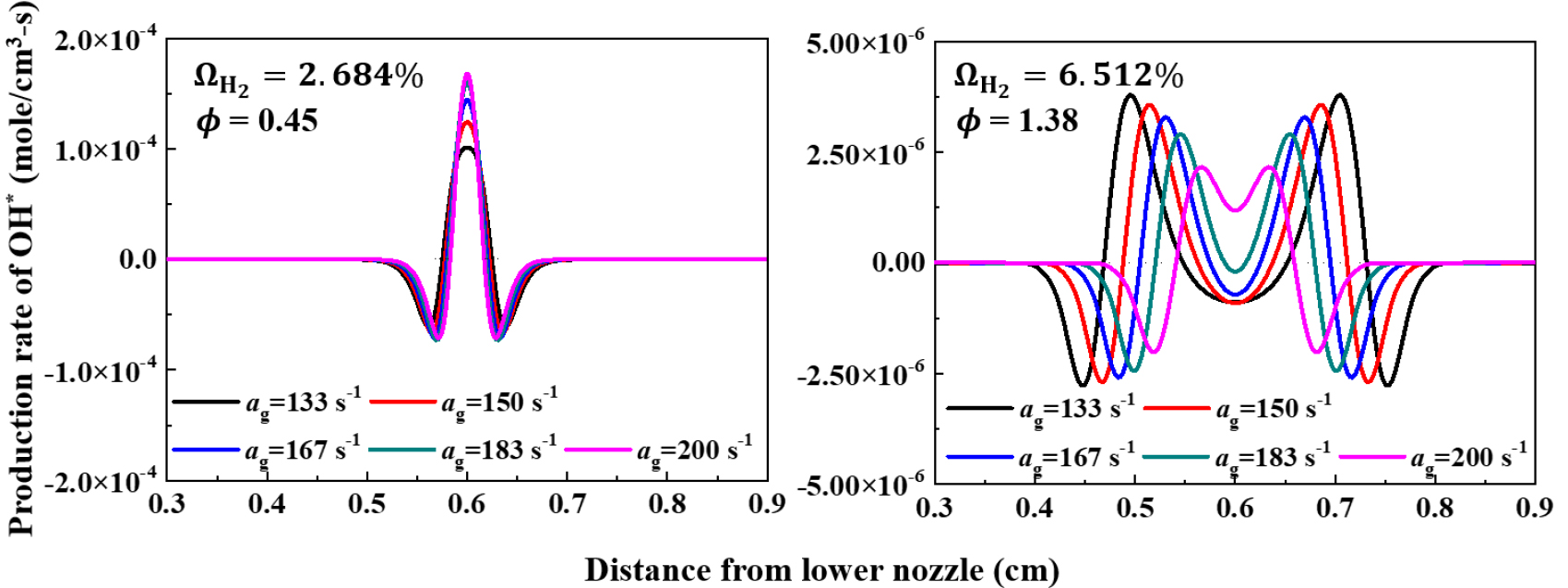
다음으로 희박 소화경계와 과농 소화경계에서의 신장률 변화에 따른 화학반응률의 척도를 파악하기 위하여 OH 활성기와 NH2 활성기 생성률을 계산하였다. OH 활성기는 연소 시 전체 화학반응률에 주요한 영향을 미치는 활성기로 알려져있으며, Fig. 7에서 조건에서 각각 희박 소화경계(LEB, ϕ=0.45) 조건과 과농 소화경계(ϕ=1.38) 조건의 OH 활성기의 생성률을 나타내었다. 신장률에 따른 OH 활성기의 생성률을 관찰하기 위하여 두 조건에서 소화점에 이르기까지 신장률을 조금씩 증가시켰다. 희박 소화경계(LEB) 조건의 경우 신장률에 상관없이 OH 활성기가 정체점에서 가장 활발한 생성 반응을 보인다. 이는 두 화염간의 거리가 과농 소화경계(REB) 조건에 비해 매우 가까워 정체점에서 활발한 활성기 간의 반응으로 OH 생성률이 최대 값을 갖는 것으로 해석할 수 있다. 또한 신장률이 증가하면서 정체점에서 OH 활성기의 최대 생성률 값은 증가하며 신장률 증가로 인하여 활성기 간의 공유가 더욱 활발해지는 것을 알 수 있다. 다음으로 과농 소화경계(REB) 조건을 살펴보면 희박 소화경계(LEB) 조건과 다르게 OH 활성기의 생성률이 최대인 지점이 정체점에서 떨어져 있다. 또한 y축의 생성률 값의 스케일을 보면 과농 소화경계조건이 더욱 적은 값을 가지며 OH 생성률의 상당한 차이를 확인할 수 있다. 신장률이 증가하면서 OH 활성기가 최대로 생성되는 지점은 정체점에 근접해 지지만 생성률 값은 점차 줄어드는 것을 확인 할 수 있다. 이는 과농 소화경계 조건에서는 신장률이 증가 해도 활성기 간의 공유가 충분히 일어나지 않아 OH 활성기의 생성률이 점점 낮아지는 것으로 해석할 수 있다.
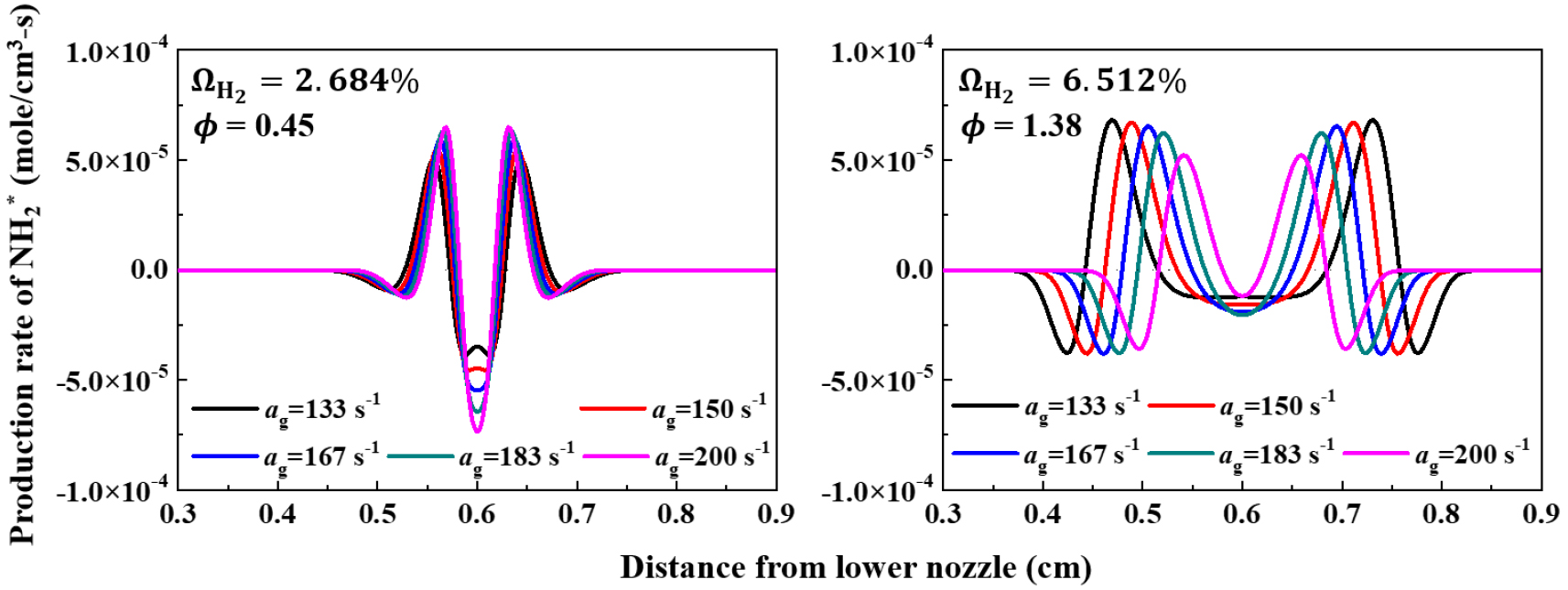
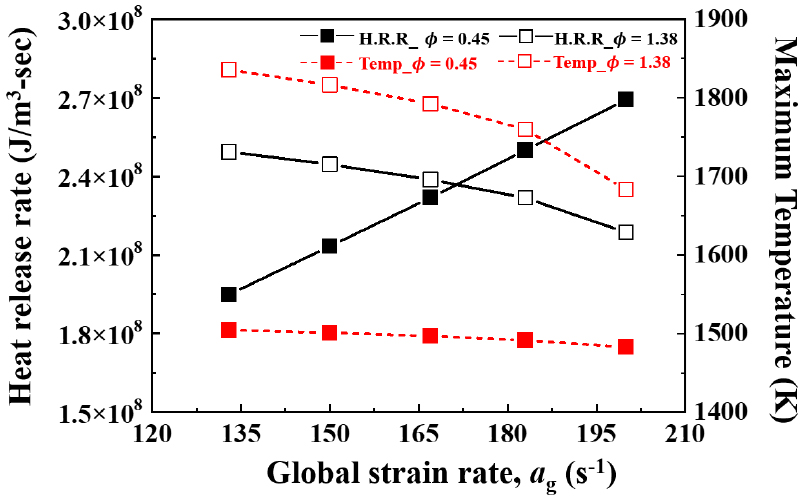
OH 활성기 생성률을 통해 희박 소화경계(LEB) 조건과 과농 소화경계(REB) 조건에서 신장률에 따른 화학 반응률의 경향을 파악할 수 있었다. 추가적으로 이러한 OH 활성기 생성률을 활성화시키는 메커니즘에 대하여 상세히 분석할 필요가 있다. NH2 활성기는 암모니아의 산화 반응 시 초기에 OH 활성기와 반응하며 생성되는 활성기이다. Fig. 8에서 희박 소화경계(LEB) 조건과 과농 소화경계(REB) 조건에서의 NH2 활성기의 생성률을 나타내었다. NH2 활성기 또한 Fig. 7의 OH 활성기의 생성률과 마찬가지로 희박소화경계 조건의 경우 정체점에서 NH2 활성기의 반응률(소모율)이 최대값을 가지며, 신장률이 증가하면서 반응률(소모율)이 점차 증가하는 것을 알 수 있다. 반대로 과농소화경계 조건의 경우 NH2 활성기의 반응률(소모율)이 정체점으로부터의 거리가 더 먼 지점에서 최대값을 가지며, 신장률이 증가할수록 최대 반응률(소모율) 값은 줄어드는 것을 알 수 있다. 희박 소화경계에서 Fig. 7의 OH 활성기 생성률과 Fig. 8의 NH2 활성기 생성률을 비교했을 때 두 활성기의 같은 지점에서 생성률과 소모율의 경향이 서로 대응하는 것을 볼 수 있다. 이를 통해 희박 소화 경계 조건에서 OH, NH2 활성기는 연쇄반응에 의하여 서로 생성 및 소모 반응을 촉진시킨다는 것을 알 수 있다. 그러나 과농 소화 경게 조건에서는 OH, NH2 활성기의 반응률에 차이를 보이는데, OH 활성기의 반응률은 NH2 활성기의 반응률에 비해 적은 값을 가진다. 이는 희박 소화경계 조건과 달리 과농 소화 경계 조건에서는 OH, NH2 활성기 간에 연쇄 반응이 활발히 일어나지 않는 것으로 해석 할 수 있다. 다음으로 방금 살펴보았던 희박 소화 경계(LEB) 조건과 과농 소화경계(REB) 조건에서 소화지점까지 신장률을 조금씩 늘려가면서 열 방출률(heat release rate)과 최대온도의 변화를 Fig. 9에 나타내었다. Fig. 9에서 검은색 실선은 열방출률 나타내고, 빨간색 점선은 최대온도를 나타낸다. 속이 찬 심볼과 속이 빈 심볼은 각각 = 200 s-1에서 희박소화경계(LEB, ϕ=0.45)조건, 과농소화경계(REB, ϕ=1.38)조건을 나타낸다. 열방출률은 희박소화경계 조건에서는 신장률이 증가하면서 선형적으로 증가하지만 과농 소화경계 조건에서는 반대로 감소하는 경향을 보인다. 이는 Fig. 7와 Fig. 8에서 OH, NH2 활성기의 반응률 경향과 일치하는 것을 보여준다. 화염의 최대 온도는 희박, 과농 소화경계조건 모두 신장률이 증가하면서 감소하지만 희박 소화경계 조건은 매우 완만한 기울기를 가지며 감소하고, 과농소화경계 조건은 소화점에 다다를수록 더욱 급격한 기울기를 가지며 하강한다. 이는 루이스 수를 통해 해석이 가능한데, 희박 조건의 경우 Le < 1이므로 열확산률보다 질량확산률이 더 큰 값을 가지며 불완전 반응(incomplete reaction)을 하게 된다. 그로 인해 후류에서 활성기들 간의 추가적인 화학반응 및 상호작용으로 최대 온도가 증가하다가 정체점에서 최대 온도가 서서히 낮아지면서 소화하게 된다. 과농 조건의 경우 Le > 1이므로 질량확산률보다 열확산률이 더 큰 값을 가지며 완전반응(complete reaction)을 하게 된다. 그로 인해 신장률이 증가하면서 열손실로 인하여 화염의 최대온도가 급격히 낮아지며 소화하게 된다. 지금까지 OH, NH2 활성기의 생성률을 통해 희박 소화경계(LEB) 조건과 과농 소화경계(REB) 조건에서 신장률에 따른 화염의 반응률에 대한 경향을 파악할 수 있었다. 다음 장에서는 전체적인 화염의 구조를 파악하여 상호작용 및 소화체계에 대해 더욱 상세히 규명하고자 한다.
3.3 화염의 구조
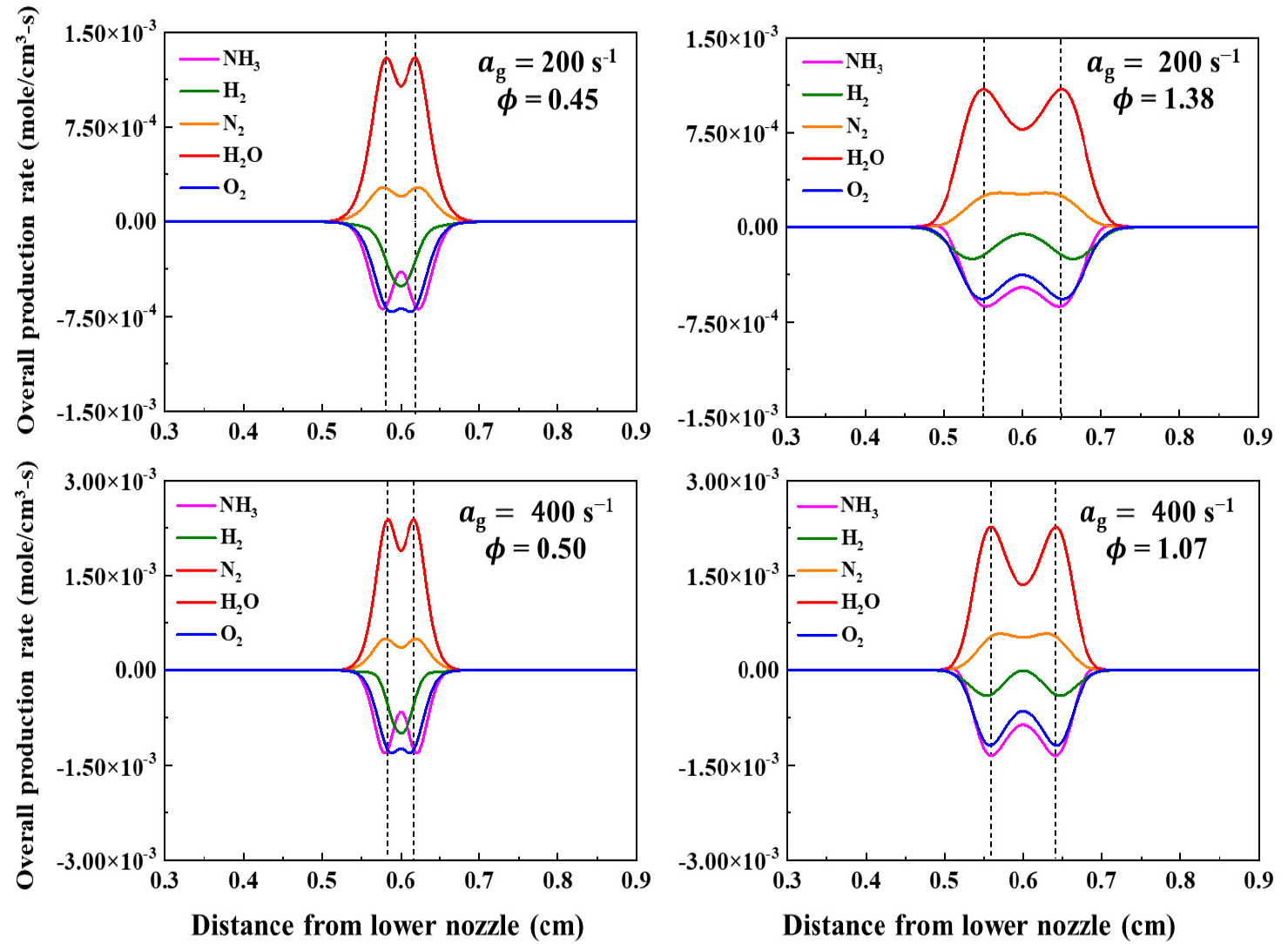
다음으로 주요 화학종, 핵심 활성기의 생성률을 통하여 화염의 구조를 파악하고, 소화체계를 분석하였다. 화염의 구조는 수치해석을 통해 신장률 = 200 s-1의 LEB(ϕ=0.45), REB(ϕ=1.38) 조건과 = 400 s-1의 LEB(ϕ=0.50), REB(ϕ=1.07) 조건에서 파악하였다. Fig. 10, Fig. 11, Fig. 12은 각각 화염의 주요 화학종, 핵심 활성기, 화학 반응 경로의 반응률을 나타낸 그래프이다. 그래프에서 점선은 열 방출률로 정의한 화염의 위치를 표시한 것이다. Fig. 10의 모든 조건에서 H2O 생성률이 최대인 지점과 화염대가 일치하며, H2O 생성 반응이 화염의 열방출률에 큰 영향을 끼친다는 것을 알 수 있다. H2의 반응률은 LEB 조건과 REB 조건이 서로 다른 경향을 보이는데, LEB 조건에서는 H2가 선호 확산으로 인하여 NH3보다 후류 지점인 정체점에서 가장 활발한 소모반응이 일어나는 것을 알 수 있다. 이는 H2의 낮은 부족반응물 루이스수(LeD)와 관련지어 설명할 수 있다. 수소는 ϕ=0.5~1.5 범위에서 LeD=0.43~0.66의 값을 가지며, 루이스 수의 열 확산도에 비해 질량 확산도의 항이 더 우세하다는 것을 알 수 있다. 당량비가 희박한 구간에서는 수소의 질량 확산도의 값이 지배적이므로, NH3에 비해 더 후류 지점인 정체점에서 가장 활발한 H2 소모 반응률을 보인다. H2는 과농 구간에서도 LeD가 1보다 작으며 여전히 질량 확산도의 값이 지배적이나, REB 조건에서 NH3와 H2의 소모반응 지점은 거의 일치하는 것을 알 수 있다. 이는 화염대 근처에서 거의 대부분의 연료가 모두 소모하며 완전한 반응이 이루어지는 것으로 사료 된다.
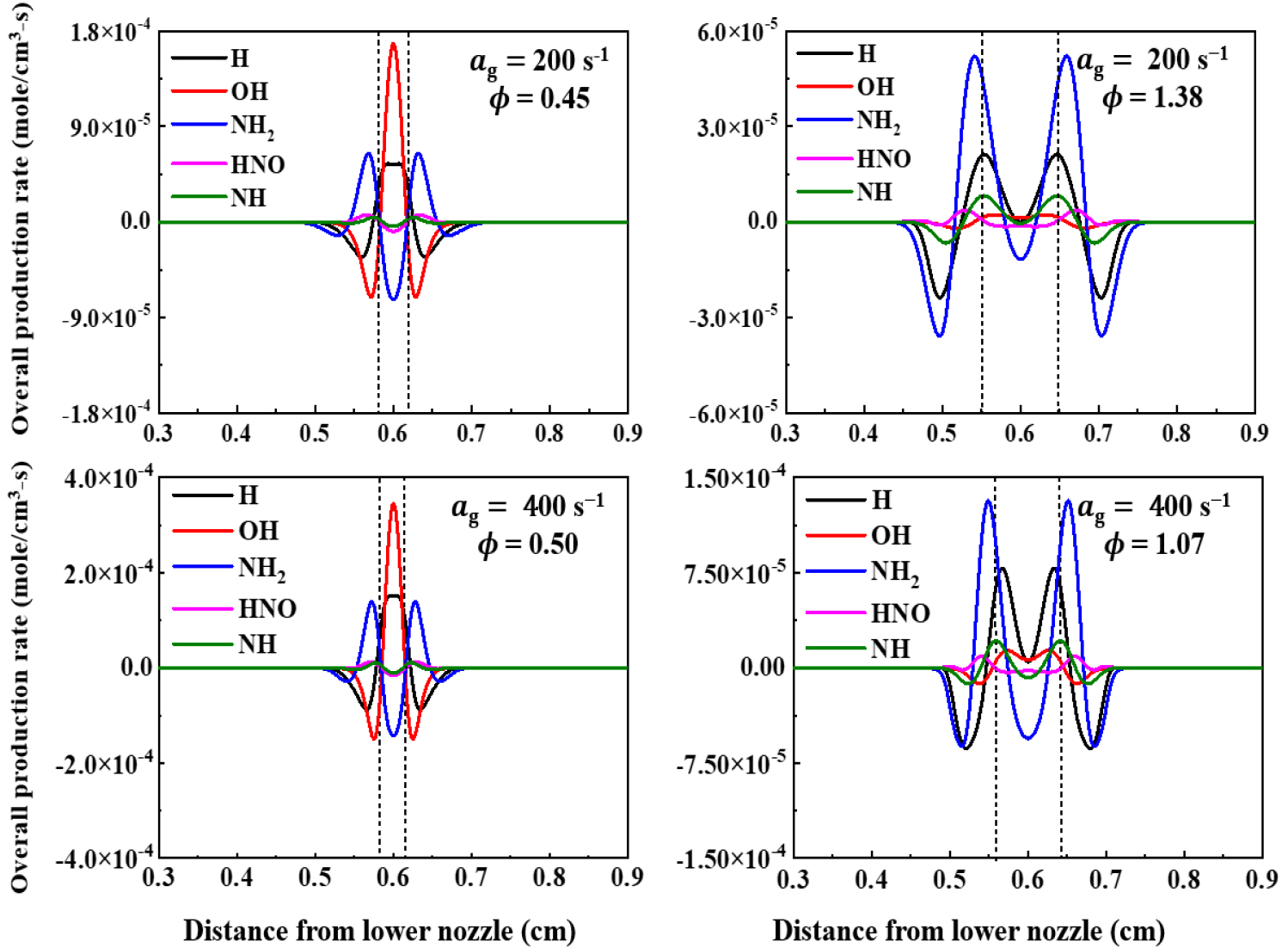
다음으로 H2의 선호확산과 소화거동 등 더욱 세밀한 화학반응 메카니즘을 파악하기 위하여 화학반응의 주요한 핵심 활성기들의 반응률에 대한 결과를 Fig. 11에 나타내었다. Fig. 11의 LEB 조건에서 H 활성기의 생성률은 정체점에서 활발하며, REB 조건에서는 화염대에서 활발한 생성반응을 보인다. H 활성기 또한 LEB 조건에서 선호확산으로 인하여 정체점에서 활발한 반응률을 보인다. 정체점에서 생성되는 H 활성기는 다른 화학종들 간의 화학반응을 촉진시키며, 특히 H+O2↔OH+O의 반응률을 촉진시켜 OH 활성기의 생성률을 증가시킨다. 또한 화염대 근처에서 활성기들의 반응이 가장 활발하며, 화염대 이후 정체점에 가까워질수록 활성기들의 반응률은 낮아지는 것을 알 수 있다. = 400 s-1에서 LEB 조건의 활성기 반응률은 차이가 거의 없지만, REB 조건에서 신장률 증가로 인하여 화염대 간의 거리가 조금 가까워지며 H 활성기 생성률은 줄어들긴 하지만 정체점에서 양의 생성률을 유지하며, OH 활성기의 생성률이 증가하는 것을 알 수 있다. HNO 활성기는 OH 및 H 활성기와 결합하여 HNO+H↔H2+NO, HNO+OH↔NO+H2O 반응식을 통해 안정적인 생성물을 형성하며, 연쇄 정지 반응을 유도한다[28]. HNO 활성기는 LEB, REB 조건 모두 동일하게 화염대 이전에서 생성하는 경향을 가진다. HNO 활성기는 LEB 조건에서는 정체점에서 약간 소모하여 음의 방향으로 움푹 파인 형상을 나타내고, REB 조건에는 정체점에 다다르면서 반응률이 0에 수렴해가는 것을 알 수 있다. 이와 같은 차이는 LEB 조건에서 HNO 활성기가 정체점에서 추가적인 화학 반응이 일어난다는 것으로 해석할 수 있다.
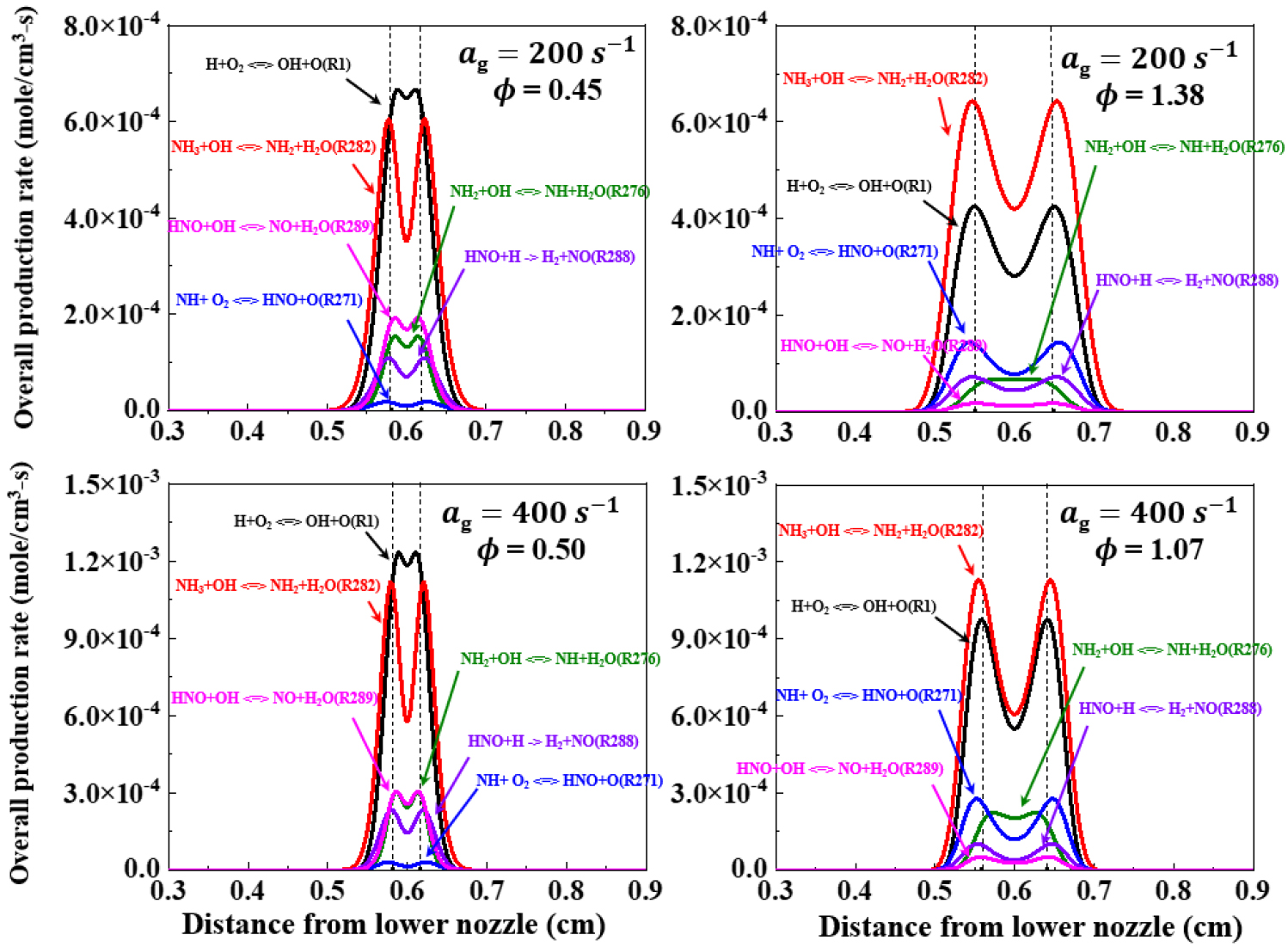
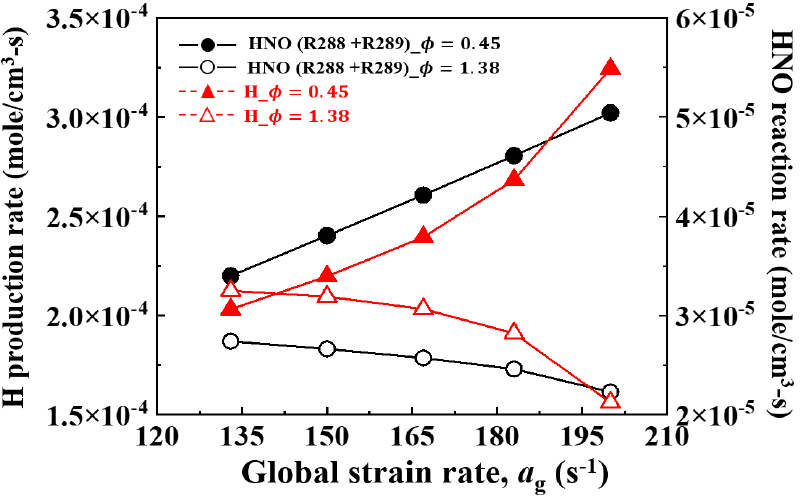
Fig. 12에서 화염의 주요 반응 경로에 대한 반응률을 그래프로 나타내었다. LEB 조건에서 가장 지배적인 반응식은 H+O2↔OH+O(R1)이고, REB 조건에서는 가장 지배적인 반응식이 NH3+OH↔NH2+H2O(R282)이다. NH3은 연쇄 산화반응을 거쳐 순차적으로 NH3 → NH2 → NH → HNO를 생성하게 된다. NH3+OH↔NH2+H2O(R282) 반응은 NH3 연소에서 화염의 열방출을 유도하는 주요한 화학 반응식으로 알려져 있다[29]. 이 반응은 NH2와 H2O를 생성하며 강한 열방출을 발생시킨다. 이 과정에서 생성된 NH2는 OH 활성기와 추가로 반응하며 다시 NH2+OH↔NH+H2O 반응식을 통해 NH와 H2O를 생성한다. NH는 다시 추가 반응을 통해 최종적으로 HNO 활성기를 생성하게 된다. 이런 연쇄적인 NH3의 산화반응은 LEB, REB 조건 모두 화염대에서 가장 활발하게 발생하는 것을 알 수 있다. HNO 활성기는 H 또는 OH와 추가로 반응하게 되는데, 이때 HNO+H↔H2+NO(R288), HNO+OH↔NO+H2O(R289) 연쇄 정지 반응으로 이어지게 된다. LEB 조건에서 R288, R289 반응률이 REB 조건에 비해 활발한데 이는 정체점에서 H의 선호 확산과 H 선호 확산으로 인한 R1의 높은 반응률 통해 생성되는 OH와의 결합을 촉진 시키는 것으로 해석할 수 있다. 다음으로 Fig. 13에서 LEB 조건과 REB 조건에서 화염 소화 직전까지 신장률을 늘려가며 H 활성기와 HNO 활성기를 포함한 R288, R289의 반응률을 그래프로 나타내었다. LEB 조건의 경우 소화 직전까지 신장률이 증가하면서 H 활성기가 증가하는 동시에 HNO 활성기를 포함한 R288, R289의 반응률 또한 증가하는 것을 알 수 있다. 반면 REB 조건에서는 오히려 신장률이 증가하면서 감소하는 경향을 나타낸다.
4. 결 론
암모니아 부분 크래킹 모사 연료 NH3/H2/N2의 소화거동 특성을 파악하기 위하여 대향류 연소기 내 예혼합화염에 대하여 실험과 수치해석을 수행하였으며, 다음과 같은 결론을 도출하였다.
1)암모니아 크래킹 비율 16%의 연료 성분인 NH3/H2/N2 72:21:7(21% H2)의 적합한 수치해석을 위해 실험적 소화경계와 5가지 화학 반응 기구의 소화경계를 비교하였다. UCSD 메카니즘이 실험적 소화경계의 경향을 근접하게 모사하며, 가장 적은 오차율을 가졌다. 화염의 시간(tF, s)과 소화직전 화염의 국부 신장률( , s-1)의 곱으로 정의되는 무차원 지수인 RSIB(Resilience to strain-induced blow-out) 특성을 CH4 연료와 비교한 결과, 희박 조건에서는 부분 크래킹 모사연료의 RSIB가 더 큰 값을 가지는 것을 확인하였다.
2)전체 신장률( )과 H2의 체적분률을 소화거동의 주요 변수로 두어 화염의 안정화선도를 나타내었다. 전체 신장률이 증가하면서 화염의 소화경계는 좁아지며 = 1023 s-1에서 ϕ=0.71인 한 지점에서만 생존하였다. 희박 소화경계는 기울어진 형태를 가지고, 과농 소화경계의 기울기는 완만한 경향을 가진다. 이는 희박 소화경계에서 화염의 상호작용이 강하며, 신장률 증가가 화염의 상호작용에 긍정적인 영향을 미치는 것으로 판단하였다.
3)LEB 조건에서는 소화직전 화염이 서로 병합하며 소화하고, REB 조건에서는 소화직전 화염 간의 일정한 거리를 가지며 소화하는 것을 실험과 수치해석을 통해 확인하였다. 신장률을 조금씩 늘려가며 = 200 s-1 소화지점에 다다를 때 LEB(ϕ=0.45) 조건에서 OH 활성기와, NH2 활성기의 생성률은 신장률이 증가하면서 증가하는 경향을 보였다. 반대로 REB(ϕ=1.38) 조건에서는 신장률 증가에 따라 OH 활성기와 NH2 활성기의 생성률은 감소하는 경향을 보였다.
4) = 200 s-1, = 400 s-1의 LEB 조건에서 H2는 선호확산으로 인하여 NH3의 반응률이 활발한지점보다 후류 지점인 정체점에서 활발한 화학반응이 일어났다.
5)LEB 조건에서는 수소(H)의 선호 확산으로 인하여 정체점에서 활성기 간 공유가 활발해지며 강한 상호작용을 보였다. 수소(H) 선호 확산으로 인하여 H+O2↔ OH+O(R1) 반응률이 증가하지만, 동시에 연쇄 정지 반응인 HNO+H↔H2+NO(R288), HNO+OH↔NO+H2O (R289) 반응률 또한 증가하며 소화거동에 영향 끼치는 것을 확인하였다.