1. 서 론
2. 수치해석 방법
3. 결과 및 고찰
3.1 암모니아 일반 연소에서의 화염 구조 및 열방출 특성
3.2 암모니아 전환에 따른 MILD 연소 특성
3.3 질소산화물 배출 특성
4. 결 론
1. 서 론
해수면 상승, 지구온난화 등의 환경 문제가 심각해지면서 전 세계 195개국은 파리 기후변화협정을 채택하여 온실가스 감축을 위해 노력하고 있다. 이 협정에는 2030년까지 국제사회에 감축 이행을 약속하는 온실가스 감축 목표(NDC)를 포함하고 있으며[1], 우리나라는 2018년 온실가스 총 배출량 대비 40% 감축을 제시하고 있다[2].
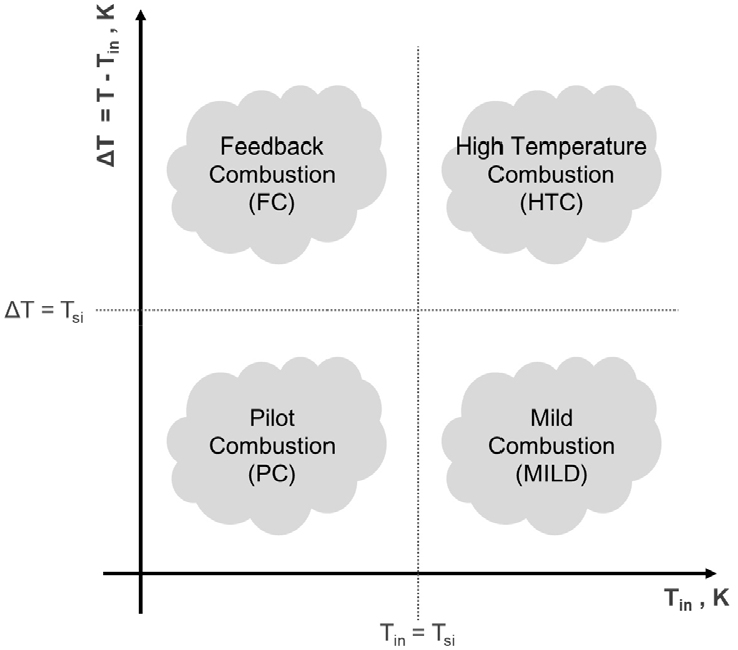
온실가스의 주원인인 이산화탄소는 탄화수소계 연료를 무탄소계 연료인 수소로 대체함으로써 감축을 기대할 수 있다. 탄소중립 시나리오에 따르면 국내의 수소 사용량은 현재 22만 톤 수준에서 2050년 약 2700만 톤까지 증가할 것으로 예상된다[3]. 하지만 이 중 80% 이상을 해외에서 수입할 것으로 예상되기 때문에 우리나라의 수소 해외 의존도가 높을 것으로 보인다[4]. 수소는 단위 부피 당 에너지 저장 밀도가 낮기 때문에[5] 수소를 운송, 저장하기 위한 다양한 방법들이 연구 중에 있으며 그중 암모니아의 형태로 수소를 질소와 합성하는 방식이 있다. 암모니아는 다시 분해하여 수소를 사용하거나 그대로를 연료로써 사용할 수 있다. 본 연구는 암모니아를 분해하여 생성된 수소-암모니아-질소 혼합가스를 연료로써 활용하는 것을 목적으로 하고 있다. Fig. 1은 온도와 압력에 따라 암모니아 열분해 시 생성되는 수소와 질소의 몰분율을 평형 계산을 통해 나타낸 결과이다. 온도는 50 K 간격으로 300 - 1100 K, 압력은 1, 5, 10, 그리고 30 atm에서 계산되었다. 평형 계산에 따르면 암모니아는 1 atm에서는 약 750 K 이상에서 완전히 분해된다. 하지만 암모니아는 질소 분자를 포함하고 있기 때문에 암모니아 연소 시 연료 질소산화물(Fuel NOx)이 생성되고, 암모니아 분해에 의해 생성된 수소는 탄화수소계 연료에 비해 발열량과 단열화염온도가 높아[6] 추가적인 열적 질소산화물(Thermal NOx) 배출 가능성이 높다. Thermal NOx 배출량을 감축하는 방법 중 하나로 MILD(Moderate or Intense Low oxygen Dilution) 연소가 있다. MILD 연소는 일반적인 연소와는 다르게 가시적인 화염이 없어 온도 분포가 균일하고, 최대 온도가 낮은 특징이 있어 Thermal NOx의 배출량을 감소시킨다[7]. Cavaliere et al.[7]에 따르면 연소 영역을 Fig. 2와 같이 나타낼 수 있다. Tsi(자발화온도)를 기준으로, ∆T(최대 온도 – 투입 온도)와 Tin(투입온도)가 더 클 때를 High temperature combustion(HTC)으로, 작을 때를 Pilot combustion(PC)[8]으로 명명하였다. Tsi가 Tin보다 작고 ∆T보다 클 때는 Feedback combustion(FC), 그리고 Tsi가 Tin보다 크고 동시에 ∆T보다 작을 때는 MILD combustion이라고 정의하였다.
수소와 암모니아의 혼합률에 따른 연소 특성 및 질소산화물 배출에 관한 연구가 선행적으로 수행되었다[9,10,11]. 이와 더불어, 암모니아 연소 시 질소산화물을 줄일 수 있는 방법에 대해서도 연구가 진행되었다[12]. MILD 연소는 배가스 재순환을 통해 달성할 수 있다고 알려져 있다[13]. 기존 연구에서는 암모니아와 수소의 혼합률에 따른 연소 특성에 대한 여러 연구가 수행되고 있으나, 암모니아 열분해에 의한 수소-암모니아-질소 혼합기체를 연료로 한 MILD 연소 특성에 대한 연구는 미미하여 이에 대한 수치해석적 선행연구가 필요하다고 생각한다. 그러므로 본 연구에서는 암모니아 전환율 및 배가스 재순환율에 따른 수소-암모니아-질소 혼합기체의 MILD 연소 및 화학적 반응 특성을 수치해석기법을 활용하여 분석하고자 한다.
2. 수치해석 방법
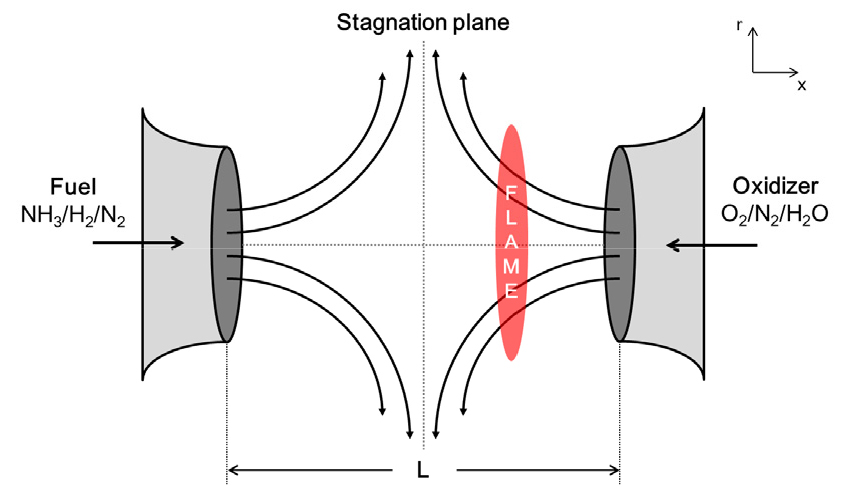
본 연구에 적용된 대상 연구 모델은 Chemkin 의 0D 예혼합 모델인 0D Homogeneous model과 1D 비예혼합 모델인 OPPDIF model[14]이다. 1차원 모델의 경우, 선행적으로 수행된 무화염 연소 시스템의 버너 형상[15]을 기준으로 반응물의 경계 조건을 단순화하기 위해 Fig. 3와 같은 구조를 갖는 대향류 확산 화염 모델이 사용되었다. 서로 마주보는 두 노즐에서 각각 연료와 산화제가 분사되며 반응물의 경계 조건을 단순화하기 위해 배가스 재순환율에 의해 계산된 재순환 가스는 연료와의 혼합을 무시하고 산화제와의 혼합만을 가정하여 해석을 수행하였다. 수소-암모니아-질소 혼합 연료의 모사를 위한 상세 화학 반응 메커니즘으로는 실험 결과 및 다른 메커니즘과의 비교를 통해 검증을 거친 Rui Li et al.[16]의 메커니즘을 사용하였다. 이 메커니즘은 28개의 화학종과 218개의 화학반응으로 구성되어 있다.
Table 1.
Simulated conditions
| Fuel | Inlet temperature | |
|
Ammonia conversion rate (CR, ) : 0-100% | 0-3 |
700-1500 K (OPPDIF model : 1000 K) |
본 연구의 계산 조건은 Table 1에 나타내었다. Table 1의 모든 조건에서 연료 유속()은 25 cm s-1로 고정하였으며 산화제 유속()은 식 (1)에 따라 화염 신장률(Strain rate, )이 50 s-1을 만족하도록 조건별로 변경되었다.
위 식에서 아래첨자 와 는 각각 연료와 산화제를 뜻하며, 는 입구 유속, 은 두 노즐 간의 간격, 그리고 𝜌는 가스 밀도를 나타낸다. 이 때, 은 모두 2 cm로 고정하여 계산하였다. 연료는 암모니아가 0 - 100% 열분해된 생성물을 조성으로 하여 20% 간격으로 선정하였고 식 (2)에 따라 계산되었다. 식 (2)에서 는 암모니아 전환율(≦1)을 의미하며 본 연구에서는 conversion rate(CR, %)이라고 명명하였다.
배가스 재순환율()[17]은 식 (3)과 같이 정의되었다.
위 식에서 , 그리고 는 각각 재순환가스, 초기 연료, 초기 산화제의 질량 유량이다. 본 연구에서 당량비는 모두 0.9로 고정하였으며, 이는 향후 실험적으로 수행될 무화염 연소시스템의 기준 당량비를 반영한 것이다. 연료 및 산화제의 투입 온도는 0D Homogeneous model에서 50 K 간격으로 700 - 1500 K으로 선정하였고, OPPDIF model에서는 1000 K으로 하였다.
재순환가스의 조성은 당량비와 식 (4)에 의해 계산된 몰수를 바탕으로 연소 후 생성물인 H2O, O2, N2를 고려하여 식 4-3에 의해 결정되었다.
질소산화물 배출 특성을 분석하기 위해 아래 식(5)의 배출지수(Emission Index)를 도입하였다[18].
위 식에서 는 질소산화물의 화학종이며, NO와 N2O에 해당한다. 는 의 생성률(Rate of production, ROP) 는 의 분자량, 그리고 은 연료의 질량유량을 의미한다.
3. 결과 및 고찰
3.1 암모니아 일반 연소에서의 화염 구조 및 열방출 특성
OPPDIF model를 활용하여 일반 연소 조건에서 암모니아 전소 시 공간과 혼합분율에 대한 온도, 주요 화학종의 몰분율, 그리고 열방출률을 Fig. 4와 Fig. 5에 각각 나타내었다. Fig. 3에서 0 cm 측은 연료가 투입되는 노즐, 그리고 2 cm 측은 산화제가 투입되는 노즐을 나타낸다. 연료 및 산화제 투입 온도는 예열을 고려하여 1000 K으로 설정하였다. 상온 및 상압 조건에서 암모니아의 단열화염온도는 약 1800°C[6]로 알려져있지만, 본 연구에서는 연료 및 산화제 투입 온도를 상온보다 높은 1000 K으로 선정하였기 때문에 최대 온도가 약 2410 K으로 더 높게 나타났다. 또한, 암모니아 연소 시의 온도는 이상 혼합 분율(Stoichiometric mixture fraction, Zst)인 약 0.1291 부근까지 급격히 증가하다가 감소한다. 열방출 또한 Zst 전후에서 발생했다.
3.2 암모니아 전환에 따른 MILD 연소 특성
본 연구에서는 배가스 재순환율과 암모니아 전환율에 따른 생성물의 연소 영역 변화를 알아보고자 하였다. 배가스 재순환율과 연료 조성 변화에 따른 MILD 연소 가능성을 보기 위하여 Fig. 6에 Cavaliere et al.[7]이 제시한 연소 영역을 0D Homogeneous model 계산 결과로 나타내었다. 이때 각 조건에 따른 자발화온도(Tsi)와 투입 온도가 동일해지는 지점을 Tin = Tsi 선으로 나타내고, ∆T와 자발화온도(Tsi)가 동일해지는 지점을 예측하여 ∆T = Tsi 선으로 나타내었다. 자발화온도는 10분 이내에 초기 온도 대비 200 K 상승한 지점의 온도로 결정하였다. 암모니아 전소 시 수소와 질소가 혼소된 연료에 비해 자발화온도가 높았다. 이는 암모니아의 자발화온도가 약 651°C로 반응성이 좋은 수소보다 약 80°C 높기 때문이다[19]. CR = 0%를 제외하고 연료에 수소 및 질소가 포함되어 있을 때의 연료 조성에 따른 자발화온도의 차이는 10 K 이내로 균일하였다. 또한 재순환율이 높을수록 산화제의 H2O 분율이 높아져 잠열에 의해 자발화온도가 상승하게 된다. 수소의 단열화염온도가 암모니아보다 약 310 K 높기 때문에[6] 재순환율에 관계없이 CR이 높아짐에 따라 암모니아의 분율이 작아지고 수소의 분율이 커지면서 ∆T가 증가하였다. 재순환율이 증가하면 연료의 조성과 관계없이 최대 온도가 감소하는데, 이는 재순환된 배가스에 의해 필요 현열량이 증가하였기 때문이다.
MILD 연소 조건을 충족하기 위해서는 ∆T < Tsi < Tin을 만족해야 한다. 재순환율이 커질수록 ∆T가 작아지고 재순환율에 따른 Tsi의 차이는 ∆T에 비해 상대적으로 작기 때문에 MILD 연소 영역이 점차 넓어진다. 이에 따라 본 연구에서는 재순환이 없을 때는 MILD 연소 조건을 만족할 수 있는 영역이 존재하지 않지만 암모니아 전소 시에는 재순환율이 1 이상일 때, 그리고 다른 연료 조성에서는 재순환율이 2 이상일 때 MILD 연소 영역을 만족하는 것으로 예측되었다. 즉, 암모니아 전소 시 MILD 연소는 재순환율이 0 - 1 사이, 수소-암모니아-질소 혼합 연료 조성에서는 재순환율이 1 - 2 사이에서 MILD 연소 영역을 만족하는 것으로 예측되었다. 앞서 언급했듯이 재순환율이 증가하면 자발화온도가 증가하고, ∆T가 감소하기 때문에 재순환율이 4 이상인 경우 연료 조성과 상관없이 모든 조건이 MILD 연소 영역에 해당할 것이라고 예상된다. 암모니아 전소 조건을 제외한 모든 연료 조성에서는 800 K 이상에서 연소가 일어났지만, 암모니아 전소 시 더 높은 온도인 950 - 1050 K부터 연소가 일어났다. 이는 암모니아가 수소보다 반응성이 더 낮기 때문이다.
Fig. 7은 OPPDIF model을 활용하여 일반 연소 조건에서 암모니아 전환율에 따른 온도와 열방출률을 나타낸 것이다. CR이 증가할수록 수소의 함량이 높아지면서 최대 온도가 상승하였다. 수소의 단열화염온도는 약 2207°C로, 암모니아의 단열화염온도보다 약 407°C 높기 때문이다. 열방출률 그래프의 경우 수소 함량이 높아질수록 첫 번째 최댓값은 점차 커지고 두 번째 최댓값은 점차 작아졌다. 암모니아 전환율에 따른 생성물을 연료로 하였기 때문에 일반 연소 조건의 모든 연료 조성에서 이상 혼합 분율이 약 0.1291로 같다. 열방출률의 최댓값이 나타나는 혼합 분율은 모든 조건에서 이상 혼합 분율 근처에서 나타났다. 하지만 최대 화염 온도의 혼합 분율은 모든 조건에서 이상 혼합 분율보다 큰 값을 나타냈다. 연료 측에 질소를 희석하면 최고 화염 온도의 혼합 분율이 이상 혼합 분율과 일치하지 않는다는 연구 결과가 보고된바 있다[20]. CR이 높아질수록 연료 측 질소의 양이 많아지기 때문에 최대 화염 온도의 혼합 분율이 이상 혼합 분율과의 차이가 커졌다. 또한 암모니아 연료의 특성상 질소 분자가 포함되어있기 때문에 암모니아 전소의 경우에도 연료 측에 질소 희석 효과가 나타나 최대 화염 온도의 혼합 분율이 이상 혼합 분율과 일치하지 않는 결과로 이어진 것으로 추정된다.
일반 연소 조건에서 CR이 0%, 100%일 때의 열방출률 및 열방출에 관여하는 주요 화학반응을 Fig. 8에 나타내었다. 본 연구에서 수행된 열방출에 관여하는 주요 화학반응식은 Table 2에 나타내었다. 열방출률의 첫 번째 최댓값에 관여하는 화학반응은 수소만 포함되어있는 R4, R7, R20, R23 반응이다. 그 중 R7 반응은 CR이 0%일 때를 제외하고 첫 번째 최댓값에 가장 큰 영향을 주었다. 두 번째 최댓값에 관여하는 화학반응은 R29, R34, R51 반응으로, 질소 및 수소가 포함되어있는 반응이다. 이에 따라 CR이 높아질수록 첫 번째 최댓값은 커지고 두 번째 최댓값이 작아졌다. Fig. 8(b)와 같이 연료 내에 질소가 포함되어있지 않은 CR = 100%인 경우 두 번째 최댓값에 관여하는 R29, R34, R51 반응이 나타나지 않았기 때문에 하나의 최댓값만 나타났다. CR이 0%, 20%일 때는 열방출률이 음의 값인 흡열 구간이 나타나는데, 이는 R67, R167에 의해 나타나며 암모니아 분율이 낮아지면서 반응이 감소하여 흡열구간 또한 사라진다. 특히 R167은 CR = 0% 연료의 일반 연소 시에만 나타났다. 이 외에도 모든 연료 조성에서 R6 반응이 첫 번째 최댓값의 혼합 분율에서 음의 값을 나타냈지만, 양의 값을 가지는 반응들에 의해 상쇄되었다.
Table 2.
Major chemical reactions for ammonia- hydrogen combustion
Fig. 9은 재순환율이 1일 때의 연료 조성 별 혼합 분율에 따른 열방출률 및 온도를 나타낸 그래프이다. Fig. 7과 같이 수소 함량이 높아질수록 최대 온도가 증가하였다. 하지만 배가스 재순환에 의해 연소 시 요구 현열량이 증가하여 최대화염 온도가 감소하였으며, 온도 편차 역시 감소하였다. 재순환율이 높아지면 이상 혼합 분율이 작아지면서 반응이 더 낮은 혼합 분율에서 일어났다. 열방출률의 최댓값이 이상 혼합 분율에서 나타난 일반 연소와는 달리 재순환율이 1일 때 열방출률의 최댓값의 혼합 분율은 모든 조건에서 이상 혼합 분율 이하에서 나타났다. 재순환율이 높아지면서 산화제 측 H2O의 함량이 늘어나는데, 산화제 측 N2 혹은 H2O의 희석률이 높아질수록 열방출률의 최댓값의 혼합 분율이 이상 혼합 분율과 일치하지 않는다는 연구가 있다[21]. 선행 연구에서는 산화제의 희석이 많아질수록 최고 화염 온도의 혼합 분율은 이상 혼합 분율과 일치하지만 최대 열방출률의 혼합 분율은 이상 혼합 분율과 일치하지 않으면서 MILD 연소 조건을 충족한다고 하였다[21].
재순환율이 1인 경우, 질소가 포함되어있는 반응인 R29, R34, R51에 의한 열방출이 CR이 60%일 때부터 급격히 감소하면서 최댓값이 한 개로 나타났다. 배가스 재순환 조건에서는 흡열 구간이 나타나지 않았는데, 이는 일반 연소 조건에서 흡열 구간에 기여했던 R67 반응의 영향이 감소하였기 때문이다. R6과 R8 반응은 일반 연소의 경우처럼 첫 번째 최댓값이 나타나는 혼합 분율에서 흡열 반응에 기여를 하지만 다른 화학반응들의 발열 반응의 기여도가 높아 전체 반응은 발열 반응으로 나타났다.
Fig. 10에 재순환율이 3일 때 연료 조성 별 혼합 분율에 따른 열방출률 및 온도를 나타내었다. 재순환율이 3일 때에도 연료 변화에 따른 온도 변화 경향이 동일하였으며, 재순환된 배가스가 증가함에 따라 최대 화염 온도가 감소하였다. 또한 재순환율이 커짐에 따라 이상 혼합 분율이 더 작아지면서 반응 구역이 왼쪽으로 이동하면서 좁아졌다. 하지만 재순환된 배가스는 화염 온도를 낮추고 전체적인 화학 반응률을 억제하기 때문에 재순환율이 2일 때부터 암모니아 전소의 경우 소염이 발생하였다. 또한 재순환율이 높아지면서 질소가 포함된 화학 반응에 의한 열방출률이 전체적으로 감소하면서 재순환율이 3일 때는 두 번째 최댓값이 두드러지지 않아 열방출률의 최댓값이 하나로 나타났다.
3.3 질소산화물 배출 특성
Fig. 11은 배가스 재순환율이 0 - 3일 때 연료 조성에 따른 EINO를 나타낸 결과이다. NO 배출에 관여하는 화학 반응식은 Table 3에 나타내었다. 기체 연소 시 질소산화물 배출 중 가장 큰 비중을 차지하는 Thermal NOx는 공기 중의 질소가 고온에서 산화되어 발생한다. 따라서 온도와 Thermal NOx는 선형적인 관계를 보인다. 수소의 단열화염온도가 암모니아보다 높으므로 연료 중 수소 분율이 증가하게 되면 Fig. 7과 같이 연소 온도가 상승하여 Thermal NOx가 증가할 수 있다. 또한 본 연구에서는 연료 내 암모니아가 포함되어있기 때문에 Thermal NOx뿐만 아니라 Fuel NOx 함께 고려해야 한다.
Table 3.
Major chemical reactions for emissions of NO
| NO. | Reaction |
| 29 | N+NO ↔ N2+O |
| 34 | NH+OH ↔ NO+H2 |
| 40 | NH+NO ↔ N2O+H |
| 60 | NH2+NO ↔ NNH+OH |
| 167 | NO+H(+M) ↔ HNO(+M) |
| 169 | HNO+H ↔ NO+H2 |
| 184 | NO+O(+M) ↔ NO2(+M) |
재순환이 배제된 일반 연소 조건에서의 EINO는 CR이 커질수록 증가하였다. 일반 연소 조건에서 CR = 100%인 경우에 R29, R169 반응이 NO 생성에 주된 영향을 주었다. 이 중 R29 반응은 Zeldovich mechanism 중 하나로, Thermal NO를 생성하는 반응이다. 일반 연소의 경우, 재순환이 고려된 경우보다 최대 화염 온도가 높고, CR이 커질수록 단열화염온도가 높은 수소의 분율이 높아지기 때문에 최대 온도가 증가한다. 그러므로 일반 연소에서 수소 분율이 높아질수록 R29 반응의 영향이 증가하여 EINO가 증가하였다.
재순환이 고려되었을 때의 EINO는 일반연소에 비해 낮은 수준으로 예측되었으며, 재순환율이 커질수록 EINO의 감소폭이 줄어들었다. CR가 증가할 경우, Kv = 0와 비교해 Kv가 1 이상의 조건에서 EINO 차이가 큰 것으로 보아 배가스 재순환에 의한 Thermal NO 억제 효과가 있음을 예상할 수 있다. CR이 0 - 60% 범위 내에서는 EINO 차이가 거의 없었으나 CR이 80% 이상에서는 EINO가 소폭 감소하였다. 이는 재순환이 고려된 조건에서 암모니아로 인해 전체 NOx 중 Fuel NO의 비중이 높아졌기 때문이다. 이와 같은 결과를 통해 배가스 재순환율을 통해 연료 내 수소 및 암모니아 함량 변화에 따른 Thermal NO와 Fuel NO의 생성량을 일정 수준으로 유지하는 것이 가능할 것으로 판단된다.
일반 연소에서 NO를 소멸시키는 반응은 R167과 R184 반응이다. 하지만 이 중 R167 반응은 재순환을 고려했을 때 CR = 100%인 연료 외의 조건에서 NO를 생성하는데 영향을 주는 반응이다. 재순환을 고려했을 때, CR = 100% 조건을 제외하고 NO를 생성하는 반응은 R34, R167, R169이고, NO를 소멸시키는 반응은 R29, R40, R60 반응이다. 이 중 R29 반응은 CR = 100% 조건에서 NO를 생성하는 반응이다. 연료 내 암모니아 포함 여부에 따라 NO 형성에 기여하는 화학 반응이 차이를 보였다. Fig. 11에서 배가스 재순환을 고려한 경우, 암모니아가 포함된 연료 조건에서는 일반 연소에서 NO 생성에 기여도가 가장 높은 R167 반응이 억제되면서 재순환율이 없는 조건과 비교하여 NO 배출량이 감소하였다. 참고로, CR이 0%일 땐 앞서 언급한 것과 같이 소염이 발생하였기 때문에 NO 배출량이 계산되지 않았다.
암모니아 연소 시 N2O의 배출도 고려할 필요가 있다는 여러 선행 연구들이 있다[22,23,24,25]. Fig. 12는 배가스 재순환율이 0 - 3일 때 연료 조성에 따른 EIN2O를 나타낸 그림이다. N2O 배출에 관여하는 화학 반응식은 Table 4에 나타내었다. N2O는 암모니아를 포함한 연료 조건에서 주로 R40에 의해 생성되고 R188, R190에 의해 소멸하였다. EIN2O은 암모니아 분율과 재순환율이 높아질수록 증가하였다. 본 연구에서 암모니아 분율 증가 시 R40의 반응률이 높아져 EIN2O가 증가하게 된다. 또한 재순환율이 높아짐에 따라 최대 화염 온도가 감소하였고, 감소한 온도의 영향에 의해 R40, R188, R190 반응률이 전체적으로 감소하였다. 하지만 N2O 소멸 반응인 R188 반응률은 온도 감소 시 급격히 줄어들어 EIN2O는 증가하게 된다. 추가적으로, A. Mohammadpour et al.[26]에 따르면 산화제 내 O2가 감소하면 N2O가 N2로 전환되는 속도가 감소하여 N2O 배출이 증가한다고 보고된 바 있다. 재순환율이 증가할수록 산화제 내 O2 분율은 감소하고 이로 인해 N2O가 증가에 일부 기여하는 것으로 판단된다. 하지만 재순환율과 상관없이 CR = 100% 조건에서 EIN2O는 무시할 만큼 작았으며, 이는 N2O가 Thermal NOx가 아닌 Fuel NOx에 의한 영향을 받는 인자라고 예상할 수 있다.
Table 4.
Major chemical reactions for emissions of N2O
| NO. | Reaction |
| 40 | NH+NO ↔ N2O+H |
| 188 | N2O(+M) ↔ N2+O(+M) |
| 190 | N2O+H ↔ N2+OH |
앞서 분석된 NO와 N2O의 생성 특성은 본 연구에서 제시한 당량비를 기준으로 예측된 결과이며, 질소산화물의 경우 해석 조건에 따라 예측 특성이 달라질 수 있기 때문에 향후 다양한 당량비에 대한 추가적인 해석이 필요할 것으로 판단된다.
4. 결 론
본 연구에서는 암모니아 전환율에 따른 생성물을 대상으로 배가스 재순환에 따른 MILD 연소 특성을 CHEMKIN의 0D와 1D 모델을 활용하여 예측 및 분석하였다. 해석을 통해 일반 연소 및 MILD 연소의 화염 구조, 열방출 특성, 질소산화물 배출 특성을 비교하였으며, 주요 결론은 다음과 같다.
1) MILD 연소 조건(∆T < Tsi < Tin)을 만족하기 위해 연료 내 수소 분율을 낮추거나 배가스 재순환율을 높여야 한다. 본 연구에서는 재순환율이 1일 때는 암모니아 전소 그리고 재순환율이 2 이상일 때는 모든 조건에서 MILD 연소 조건을 만족하였다.
2) 암모니아-수소-질소 연소에서 나타나는 두 개의 최댓값을 가진 열방출률 그래프에서 첫 번째 최댓값에 기여하는 화학반응은 수소만 관여되어 있으며, 두 번째 최댓값에 기여하는 화학반응은 질소 및 수소가 모두 포함되어 있다. 그러므로 CR = 100%에서는 하나의 최댓값만 가지며, 재순환율이 높아질수록 질소가 포함되어있는 화학 반응에 의한 열방출률이 감소하면서 최댓값이 하나로 나타났다.
3) 연료별 Zst는 동일하였으며, 재순환율이 커질수록 Zst가 감소하였다. 재순환율이 커질수록 낮은 혼합 분율에서 반응이 일어나고 반응 구역이 좁아졌다. 일반 연소 조건을 제외하고 연료 측 질소 분자의 영향과 재순환율 증가에 따른 산화제 희석에 의해 열방출률의 최댓값 및 최대 화염 온도의 혼합 분율은 Zst와 상관관계가 없었다.
4) 재순환이 없는 경우, CR이 커질수록 연료 내 수소 함량이 높아져 화염 온도 증가에 의한 Thermal NO의 영향으로 EINO 값이 증가하였다. 또한 재순환율이 높아질수록 화염 온도 감소로 인해 Thermal NO의 배출량이 감소하여 EINO는 감소하였으나, 암모니아의 질소 분자에 의한 Fuel NOx의 영향력이 높아졌다. 반대로 N2O는 연료 내 암모니아 분율이 높을수록, 그리고 화염 온도가 낮을수록 배출량이 증가하여 EIN2O 역시 증가하였다.