1. 서 론
2. 연구 방법론
2.1 화학 반응 모델
2.2 점화지연 모사
2.3 대향류 확산화염 모사
3. 결과 및 고찰
3.1 통합 화학 반응 모델의 성능 검증
3.2 점화지연 계산 결과
3.3 확산화염 계산 결과
4. 결 론
1. 서 론
내연기관의 대중화 이후 꾸준히 그 사용량이 증가한 화석연료 기반 연료는 대부분 탄화수소로 이루어져 있어 연소과정에서 필연적으로 이산화탄소(CO2)를 배출하게 되는데, CO2는 지구 온난화와 이에 따른 기후 변화의 주요 원인 중 하나로 지목되고 있다[1]. 이에 따라 다양한 방법으로 CO2 배출 총량을 줄이기 위해 기술적 접근 및 강력한 환경 규제, 국제 협의 등이 이루어지고 있다. 이 중 육상 운송 부문, 특히 가정 및 개인용 소형 차량 부문에서는 전동화 기술이 대중보급 초기 단계에 진입한 것으로 여겨지는 반면, 많은 승객이나 중량물 운송에 필수적인 대형 차량 부문과 해상, 항공 운송 부문의 경우 아직 기존 액체연료의 무게 당 에너지 밀도에 필적하는 기술 개발이 미진한 관계로 여전히 연소공학에 기반한 동력 발생 장치의 사용이 주를 이룬다.
한편 대기 중의 CO2를 포집한 후 수소(H2)와 함께 반응시켜 얻는 합성연료의 경우, 오염물 배출이 최소화된 신재생발전 기반 전기에너지를 활용하여 생산한다면 탄소 생애주기 관점에서 기존 화석연료보다 순 탄소배출량이 훨씬 줄어든다는 점이 최근 밝혀진 바 있다[2]. 위와 같이 생산된 연료를 e-fuel(electrofuel)이라고 하며, 반응 온도와 촉매 종류에 따라 다양한 분자구조를 갖는 연료를 합성할 수 있다[3]. 예를 들어 옥시메틸렌 에테르(Oxymethylene ethers, OMEs)는 일반적인 탄화수소계 연료와 달리 탄소-산소-탄소-산소-... 로 이어지는 독특한 분자구조를 갖고 있는데, 분자구조상 탄소-산소 사슬의 길이에 따라
CH3O(CH2O)nCH3, n≧1 (OME-n)
로 표현하며 OME-1은 분자구조 명명법에 의거 디메톡시메테인(dimethoxy methane)으로도 부를 수 있다. 또한 널리 알려진 함산소 연료인 디메틸에테르(dimethyl ether, DME)를 OME-0으로 생각할 수도 있다. 아래 Fig. 1에서 DME와 몇 가지 OME의 분자구조를 확인할 수 있다.
최근 들어 OME의 엔진 적용 가능성에 대한 선행 연구들이 진행된 바 있다. Omari 등은 [4] OME-1부터 5에 이르는 여러 종류를 경유와 혼합하거나 또는 OME 단독으로 실험용 단기통 엔진에서 연소시켜 엔진 출력 및 배출물, 입자상 물질 경향에 대해 실험적으로 연구하였으며, Pélerin 등은 [5] 실험용 단기통 엔진에서 OME-1 및 3-6에 대하여 다양한 엔진 부하 조건, 배기가스 재순환율(EGR%), 연료 분사 시기 등을 변수로 하여 연소 특성에 관해 실험하였다. 함산소 연료가 일부 포함되면 완전 연소를 돕게 되어 배기가스 중 입자상 물질 배출량이 감소하는데, OME 또한 분자구조 내에 다량의 산소 원자를 포함하고 있으므로 입자상 물질 저감에 큰 도움이 된다. OME는 보통 탄화수소와 비슷하게 분자상 탄소-산소 사슬 길이에 따라 물성치 및 연소 관련 특성이 비례하여 달라진다. 다음 Table 1은 국내 자동차용 경유 품질기준과 비교한 OME의 물성치[4]를 나타낸 결과이다.
Table 1.
Selected properties for OMEs and Korean national standard diesel
| Fuel type |
Boiling point (°C) | Cetane number | Lower heating value (MJ/L) |
| OME-1 | 42 | 24 | ~20 |
| OME-2 | 105 | 64 | ~20 |
| OME-3 | 156 | 71 | ~20 |
| Standard diesel | - | >52 | 35.2 |
본 연구에서는 경유의 연소 특성을 반영한 대리 연료(surrogate fuel)의 화학 반응 모델[6]과 최근 발표된 OME-2의 화학 반응 모델[7]을 이용하여 경유 대체 연료로서 OME-2를 혼합 사용할 때의 연소 특성 및 생성물 특성에 관해 모사하고자 한다. 이를 통해 향후 e-diesel 성분으로서 OME 혼합 사용시의 운전 특성 변동과 배출물 변화 경향에 대해 예상해보고자 한다.
2. 연구 방법론
2.1 화학 반응 모델
2.1.1 경유 대리 연료
경유 대리 연료로서 탄소수 12의 포화 탄화수소인 노말도데케인(n-dodecane)과 벤젠고리 1, 3번 탄소의 수소 원자를 메틸기로 치환한 메타자일렌(m-xylene)을 부피비로서 77:23으로 섞은 연료(이하 surrogate diesel, SD)를 설정하였으며, 이는 미 Lawrence Livermore 국립연구소등에서 공동으로 진행한 경유 대리 연료에 대한 상세 화학 반응 모델 개발[6]과 동일한 조건이다. 해당 반응 모델은 총 2885개의 화학종과 14903개의 반응식을 포함하고 있으며, 전산열유체 응용을 위해 대표 반응경로 위주로 축소된 모델은 총 163개의 화학종과 887개의 반응식을 포함하고 있다.
2.1.2 OME-2
현재까지 알려진 OME의 화학 반응 모델은 대부분 OME-1에 대한 것인데[8,9,10], OME-1으로 경유를 대체하기에는 세탄가 측면에서 제한되는 부분이 있다. 이에 따라 실제 연료 활용성이 보다 높은 OME-2 이상에 대한 화학 반응 모델 존재 여부에 관해 조사한 결과, 양자 수준의 제일 원리 계산결과를 바탕으로 개발된 상세 화학 반응 모델은 OME-2에 대한 De Ras 등의 연구[7]가 유일하였다. 그 외 OME-3에 대한 화학 반응 모델 관련 연구도 일부 있었으나[11,12], 대부분 기존 OME-1에 관한 연구 결과로부터 보간적 방법에 의해 화학 반응식 계수를 추정하는 방법으로 진행하였기 때문에 특히 반응 생성물의 정량적 추정에 있어 큰 오차가 있을 것으로 예상된다. 이에 따라 본 연구에서는 제일 원리 계산과 열분해 실험, 급속압축장치를 이용한 점화지연시간 측정 및 점화지연기간 중 중간 생성물의 정성ㆍ정량계측을 모두 수행하고 그 결과를 바탕으로 개발하여 어느 정도 상세 화학 반응 경로에 대한 내용이 검증되었다고 볼 수 있는 De Ras 등의 화학 반응 모델[7]을 이용하였다. 해당 모델은 총 301개의 화학종과 2251개의 반응식을 포함하고 있다.
2.1.3 경유/OME-2 혼합 연료
경유에 OME-2를 일정 부분 혼합하여 사용할 때의 연소 특성 변화를 예측하기 위해 두 연료의 화학 반응 모델을 통합하였다. 경유 대리 연료의 반응 모델을 바탕으로 OME-2 반응 모델을 추가하였으며, 확산화염 모사를 위해 필요한 물질전달 계수의 경우 기존 OME-2 반응 모델에 포함되어 있지 않기 때문에 Reaction Mechanism Generator [13] 중 Molecule Search 기능을 이용하여 OME-2 관련 화학종들의 물질전달 계수를 추가하였다. 양 모델에서 서로 중복되는 화학종 및 화학반응을 제거한 후의 화학종 및 화학반응 개수는 상세 모델의 경우 각각 3065개와 16445개, 축소 모델의 경우 각각 363개와 2889개이다.
2.2 점화지연 모사
혼합 연료 사용시 예상되는 착화성 변화 가운데 연료 분무에 따른 물리적 효과를 배제하고 연료 조성 변화에 따른 화학적 효과만을 확인하기 위하여, 무차원 정적상태에서 공기와 예혼합된 연료의 점화지연을 혼합 연료의 상세 모델을 이용하여 계산하였다. Python 환경에서 열화학 관련 계산 소프트웨어인 Cantera[14]에 포함된 0-D homogeneous batch reactor model을 이용하여 계산하였으며, 해당 모델은 시스템 외부로의 열전달이 없는 이상적인 상황을 가정하였고 자발화 화학반응에 의해 혼합기 온도가 1300 K에 도달하면 자발화가 발생한 것으로 간주하였다. 이 때 점화지연 시간(ignition delay time, IDT)은 자발화 관련 연구에서 가장 널리 통용되는 시뮬레이션 초기 상태로부터 압력 상승률 최대 시점((dP/dt)max) 까지 소요된 시간으로 정의하였다. 탄소-탄소 사슬 길이가 4~5 이상일 때 주로 저온 영역(< 850 K)에서 발생하는 냉염(cool-flame)에 의한 2단 점화가 나타나는 경우, 1차 점화지연 시간(cool-flame delay, CF)과 IDT를 모두 계산하였다. Fig. 2는 압력 및 압력 상승률에 의한 CF와 IDT의 예시를 나타낸다.
2.3 대향류 확산화염 모사
확산화염면에서 생성되는 다양한 연소 생성물 및 입자상 물질 전구체 형성 경향을 예측하기 위하여, 혼합 연료의 축소 반응 모델과 Python 환경에서 Cantera에 포함된 counterflow diffusion flame model을 이용하였다. 본 연구에서 분자량이 크고 상온, 상압에서 액상으로 존재하며 끓는점이 높은 연료들을 사용하는데, 유사한 조건의 기존 연구들[15,16,17]에서는 연료의 응축 억제 및 안정적인 기체 상태 연료 공급 목적과 동시에 연료 종류 변경에 따른 운동량 변동과 화염 구조 변동을 최소화하기 위해 연료를 질소에 희석하고 충분히 예열한 상태로 공급되도록 초기조건을 설정하는 것을 확인할 수 있다. 본 연구에서도 이와 같은 상황을 가정하고자 연료와 질소는 몰비율로서 1:9로 혼합하고 473 K의 초기온도를 갖도록 설정하였다. 이 외에 시뮬레이션에 사용된 주요 변수 및 관련 인자들은 Table 2에서 확인할 수 있으며, 이를 바탕으로 계산한 Global strain rate은 91/s(SD)에서 97/s(OME-2) 사이의 값을 갖는다. 이 때 Global strain rate은 Seshadri와 Williams의 연구결과[18]에 따라 아래와 같이 정의되며, L은 각 출구 사이의 거리, v는 출구속도, ρ는 밀도를 의미하며 첨자 f와 o는 각각 연료 및 산화제를 의미한다.
3. 결과 및 고찰
3.1 통합 화학 반응 모델의 성능 검증
본 연구에서 사용한 SD 및 OME-2 통합 화학 반응 모델의 재현성 검증 결과를 Fig. 3에 제시하였다. SD 화학 반응 모델 개발 연구[6]에서 두 구성성분인 n-dodecane과 m-xylene 각각에 대한 점화지연 계산 결과와 해당 연구에서 검증을 위해 비교했던 관련 실험값, 그리고 본 연구에서 새로 제시하는 통합 모델을 이용한 점화지연 계산 결과를 비교해 보면, n-dodecane 및 m-xylene의 점화지연시간의 경우 계산결과와 실험값이 약간의 편차를 나타내지만 통합 모델을 이용한 계산결과 자체는 SD 화학 반응 모델을 이용하여 계산한 결과와 거의 일치하는 것을 확인할 수 있고 OME-2에 대해서는 실험값과 두 화학 반응 모델간 예측값이 잘 맞는 것을 확인할 수 있다. 한편 대향류 화염 조건에서 n-dodecane에 대한 온도분포 측정결과[19]와 통합 모델 계산 결과를 비교하면, 실험오차를 고려했을 때 화염구조를 비교적 잘 재현한다. OME-2의 경우 알려진 화염 실험결과가 없어 검증이 불가하다.
3.2 점화지연 계산 결과
3.2.1 OME-2 혼합에 따른 점화지연 경향
SD와 OME-2를 몰비율로서 25%씩 증감하며 혼합한 연료에 대하여, 700~1100 K, 40 bar, 당량비 0.6~1.5 사이의 초기 조건에 대하여 점화지연을 계산한 결과는 Fig. 4와 같다. 주어진 온도 및 압력 영역에서 OME-2의 점화지연은 SD에 비해 항상 짧으며, 두 연료의 혼합시에는 혼합 비율과 점화지연 경향성이 비례 관계에 있는 것을 확인할 수 있다. SD의 구성성분인 n-dodecane과 m-xylene, 그리고 OME-2의 세탄가를 비교해 보면, 자료에 따라 편차가 있으나 n-dodecane은 73 내지 74, m-xylene은 7의 세탄가를 갖는다[20]. 따라서 SD의 구성 비율과 세탄가 사이의 관계가 선형 관계를 이룬다고 가정하면, 본 연구에서 사용한 SD는 약 51 정도의 세탄가를 가질 것이라고 추정할 수 있다. OME-2는 Table 1에서와 같이 64의 세탄가를 가지므로 SD가 OME-2 대비 상대적으로 자발화 경향이 낮다고 판단할 수 있으며, 이는 점화지연 계산 결과와도 일맥상통함을 알 수 있다. 또한 SD와 OME-2 모두 저온 영역에서 2단 점화 현상이 나타나는데, SD의 경우 온도가 900 K 미만인 영역에서 탄소 사슬구조 내 수소 제거 및 산소 결합 반응경로가 활성화되어 연료 분자 하나로부터 2개의 수산화기(OH)를 생성하기 때문이다[6]. OME-2의 경우에도 마찬가지로 산소와 산소 사이의 탄소 원자 위치에서 수소 제거 반응이 비교적 쉽게 일어나며 이후 산소 결합 반응경로의 활성화로 연료 분자 하나로부터 2개의 OH를 생성한다[7].
3.2.2 배기가스 재순환(EGR) 가정시 점화지연 경향 변화
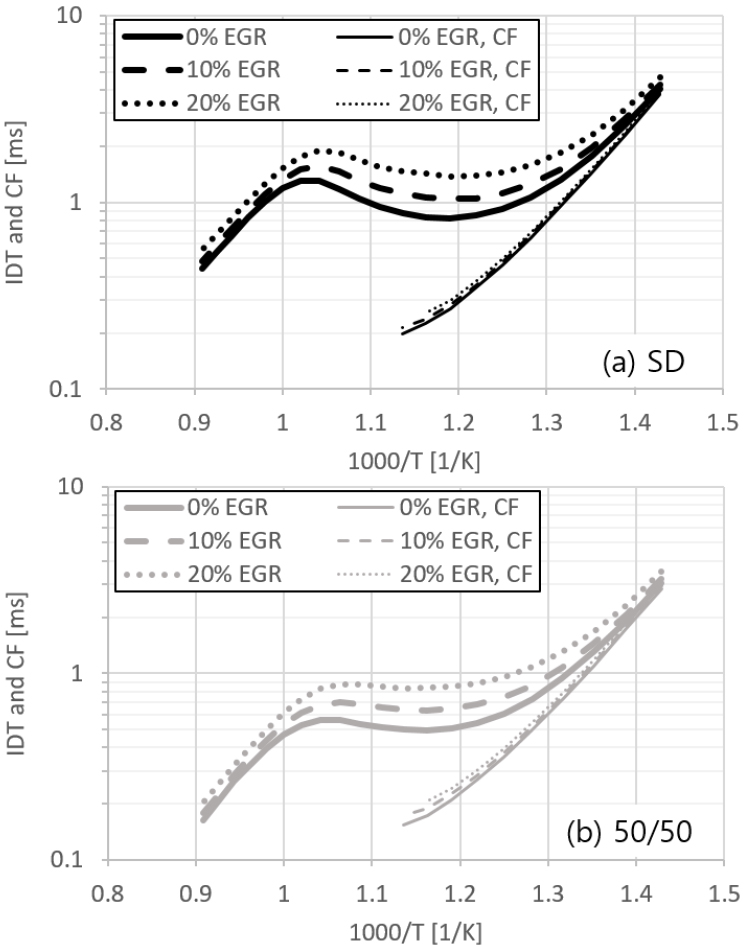
실제 압축착화 기관 운전시 연소온도 저감 등의 이유로 EGR을 사용하는 점을 반영하여, 혼합기 초기조건에 완전연소 결과물인 CO2와 물(H2O)을 유사EGR로서 포함시킨 후 점화지연을 계산하였다. 이 때 CO2와 H2O의 비율은 EGR이 없는 경우의 화학평형식에서 구한 각각의 몰수가 차지하는 비율이 그대로 유지된다고 가정하고, 초기 혼합기의 일부를 CO2와 H2O로 대체하는 것으로 생각하였다. SD와 50/50 두 가지 연료의 경우를 선택하여 EGR% 변동에 따른 점화지연 시간을 계산한 결과는 Fig. 5와 같다. 전반적으로 EGR% 증가에 따라 동일 조건에서 IDT가 길어지는 반면, CF의 경우 훨씬 미약한 증가추세가 나타나는 것을 볼 수 있다. 2단 점화에 관한 기존 연구[21] 결과를 보면, EGR% 증가에 의한 혼합기 희석 효과가 주로 IDT에서 나타나며 CF에 대해서는 그 효과가 거의 없다는 점이 알려져 있고 본 연구에서 적용한 연료에 대해서도 같은 추세가 나타남을 확인할 수 있다.
3.3 확산화염 계산 결과
3.3.1 화염 구조 및 연소 생성물 경향
3.2.1 항과 같이 SD와 OME-2를 몰비율로서 25%씩 증감하며 혼합한 연료에 대하여 확산화염 시뮬레이션을 통해 화염면 내 온도분포 및 주요 연소 생성물인 일산화탄소(CO), H2, CO2 분포에 대해 계산한 결과는 Fig. 6과 같다. 화염온도는 OME-2 혼합에 따라 점차 낮아져 OME-2 100%인 경우 최고온도는 1520 K으로 SD의 1626 K 대비 약 100 K 정도 차이나는 것을 알 수 있는데, 이는 SD 대비 낮은 OME-2의 저위발열량에 의한 것으로 생각된다. 한편 주요 연소생성물의 경우 특이한 현상을 확인할 수 있는데, 연료성분간 혼합에 관계없이 거의 일정한 몰분율을 나타내는 CO2에 비해 CO와 H2는 OME-2 혼합량이 증가할수록 크게 늘어나는 것을 볼 수 있다. 일반적으로 함산소 연료의 경우 불완전연소 결과물인 CO 발생이 거의 없으나, OME-2의 경우에는 분자구조상 다량의 포름알데하이드(CH2O)가 연소과정 중 중간생성물로서 발생하는데 생성된 CH2O는 빠른 열분해 사이클에 의해 CO와 H2로 분리된다. [7] 즉, OME-2가 포함된 연료의 확산화염에서는 CO 및 H2 생성이 촉진될 것이라 추정할 수 있다. 유사한 사례로 노말헵테인과 DME 혼합연료에 대한 대향류 확산화염 연구에서[22], DME가 혼합된 연료의 경우 CO2 총량은 거의 일정한 반면 CO와 H2 발생은 증가한다는 실험 및 시뮬레이션 결과가 있다.
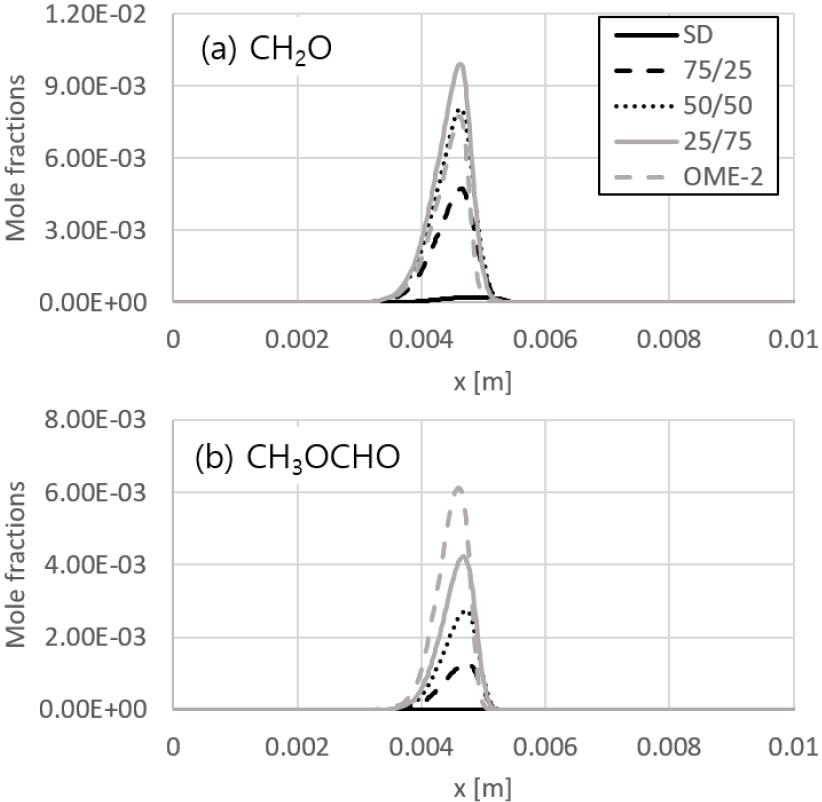
한편, OME-2 혼합량 증가에 따라 CH2O 뿐만 아니라 메틸포메이트(CH3OCHO) 생성이 급증하는 것을 Fig. 7에서 볼 수 있는데, 이는 앞에서 언급한 것과 같이 OME-2의 분자구조에서 기인한다. 즉, 열분해 반응 경로상 OME-2 1개 분자에서 β-scission과 H 제거반응에 의해 총 3개의 CH2O 또는 CH3OCHO가 형성되므로 화염 면에 다량의 CH2O와 CH3OCHO가 존재하게 된다. 다만 CH2O의 경우 OME-2 함량이 증가할수록 발생량이 비례적으로 증가하다가 오히려 0/100 연료인 경우에 감소하는 것으로 나타나는데, CH2O의 생성 및 소멸경로에 대하여 CH2O 몰분율이 최대인 지점에 해당하는 조건에서 rate of progress를 비교하면 OME-2 함량 증가에 따라 생성률과 소모율의 비가 약 10:1(75/25 연료)에서 2.3:1(0/100 연료)로 지속적으로 감소하는 것으로 계산된다. 즉, 어느 수준 이상의 OME-2가 혼합된 경우 CH2O의 빠른 열분해가 가속화되어 CO와 H2의 몰분율은 지속적으로 증가하는 반면, CH2O의 최대몰분율은 정점 이후 감소하는 추세로 전환된다고 추정할 수 있다. 특히 CH2O의 경우 1군 발암물질이며 CH3OCHO의 경우 농도에 따라 부식성이 나타날 수 있기 때문에, 실제 내연기관에서 OME 혼합 연료를 사용하고자 할 때는 기존 알코올계 대체연료 사용 차량에 대한 환경부 배출가스 기준과 유사하게 CH2O 및 CH3OCHO 배출량을 제한하기 위한 연소 전략 또는 후처리장치가 필요할 것으로 생각된다.
3.3.2 입자상 물질 전구체 형성 경향
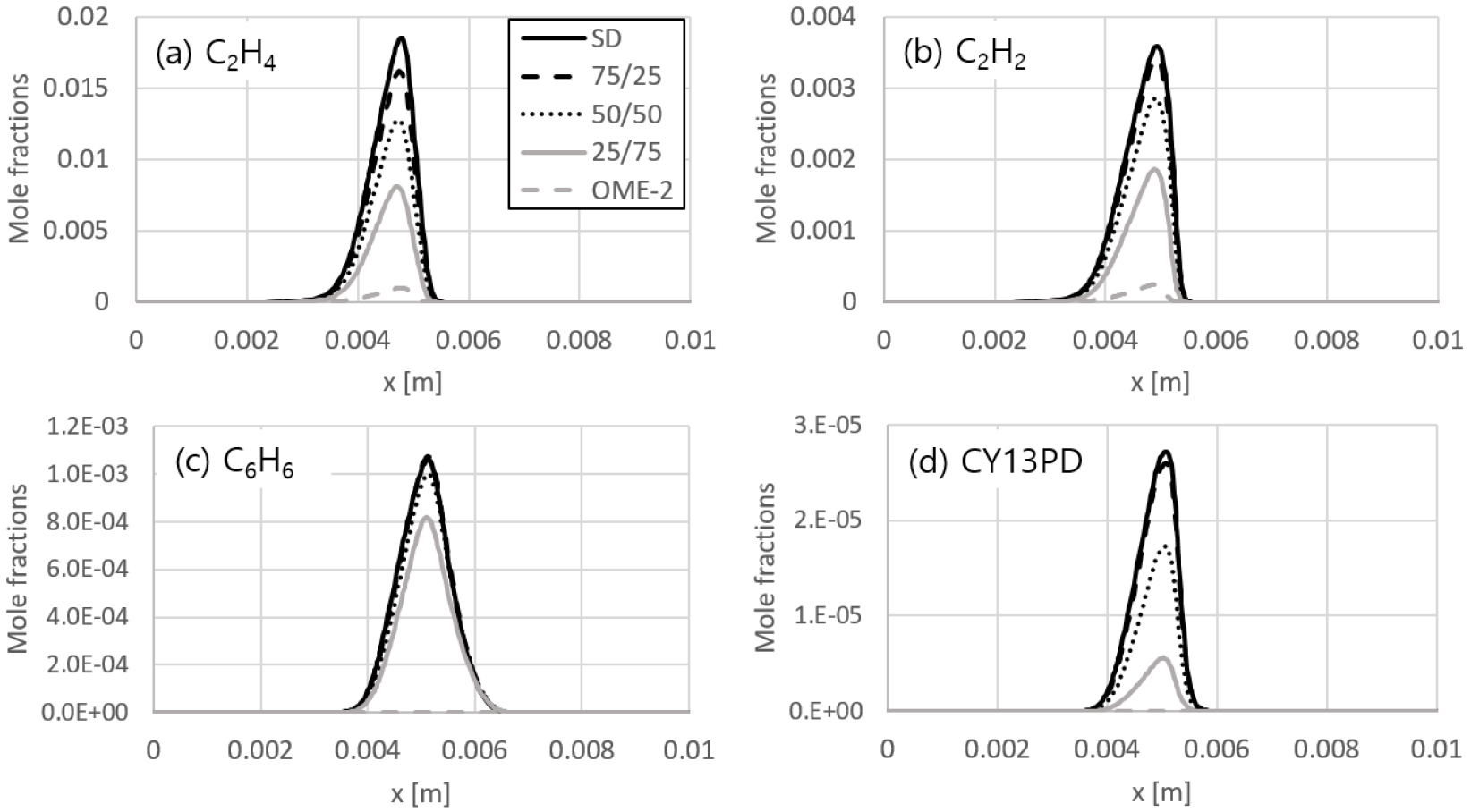
입자상 물질은 대부분 다환 방향족 탄화수소(polycyclic aromatic hydrocarbon, PAH)로부터 생성되는데, 이러한 PAH를 형성하는 전구체로는 널리 알려진 에틸렌(C2H4), 아세틸렌(C2H2), 벤젠(C6H6), 1,3-씨클로펜타디엔(CY13PD) 등이 있다. 일반적으로 비알코올계 함산소 연료 혼합시 연료의 완전 연소를 돕게 되어 입자상 물질 배출이 줄어드는데[23], OME-2에서도 동일한 경향이 나타나는 것을 Fig. 8에서 확인할 수 있다.
3.3.3 Strain rate에 따른 연소 생성물 경향
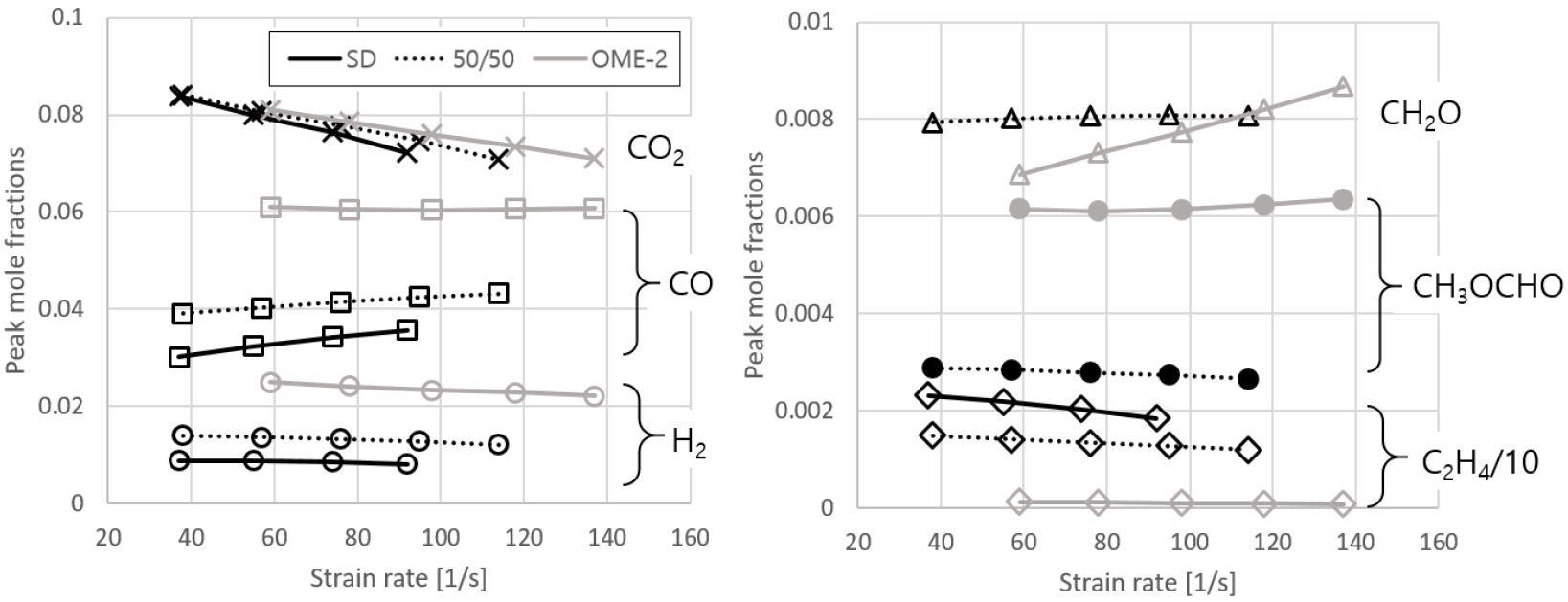
Strain rate에 따른 주요 연소 생성물 변화 경향에 관하여 SD, 50/50, 그리고 OME-2 연료에 대한 계산결과는 Fig. 9와 같다. CO2의 경우 모든 연료에 대하여 strain rate이 증가함에 따라 생성량이 감소하지만, CO나 H2, C2H4의 경우 전반적으로 큰 변화가 없는 것으로 나타난다. 한편 CH2O 생성 경향은 50/50 연료에서는 strain rate에 관계없이 거의 일정한 반면, 순수 OME-2에서는 증가하는 것으로 나타난다. 다만 OME-2에 대한 대향류 확산화염 실험결과가 아직 없으므로, 해당 부분에서의 추가 검증 및 화학 반응 모델 개선이 진행된다면 후속 연구에서 보다 정확한 해석결과를 제시할 수 있을 것으로 생각된다.
4. 결 론
본 연구에서는 탄소 생애주기 관점에서 순 탄소배출량 저감에 유리한 여러 가지 e-fuel 가운데 경유와 유사한 연소 특성을 갖는 OME-2의 혼합 사용시 예상되는 점화지연 변화 및 화염면 내 연소 생성물과 입자상 물질의 전구체 형성 경향 변화에 관하여, 경유 대리연료 및 OME-2에 대한 화학 반응 모델을 통합하여 다양한 조건에서 시뮬레이션을 수행하였다. 그 결과는 다음과 같이 정리할 수 있다.
1) 압축착화 엔진 유사조건에서 OME-2의 자발화 경향성이 경유 대리연료보다 높았으며, 이는 두 연료의 세탄가 비교 결과와도 일치하는 것을 알 수 있다.
2) 확산화염 조건에서 OME-2 혼합률 증가에 따라 CH2O 및 CH3OCHO 생성 경로가 활성화되어 생성량이 급증하며, 반면 입자상 물질 전구체의 생성은 억제되는 것을 알 수 있다. 즉, 기존 자동차용 또는 선박용 경유에 OME-2를 일정 수준 혼합하여 사용한다면 입자상 물질 배출 저감과 탄소 생애주기 관점에서의 순 탄소 배출량 저감의 이득을 얻을 수 있는 반면, 기존 경유 사용시와 다소 다른 방식의 연소 전략에 대한 연구와 적절한 후처리장치에 대한 연구가 필요할 것으로 예상된다.