1. 서 론
2. 연구 방법론
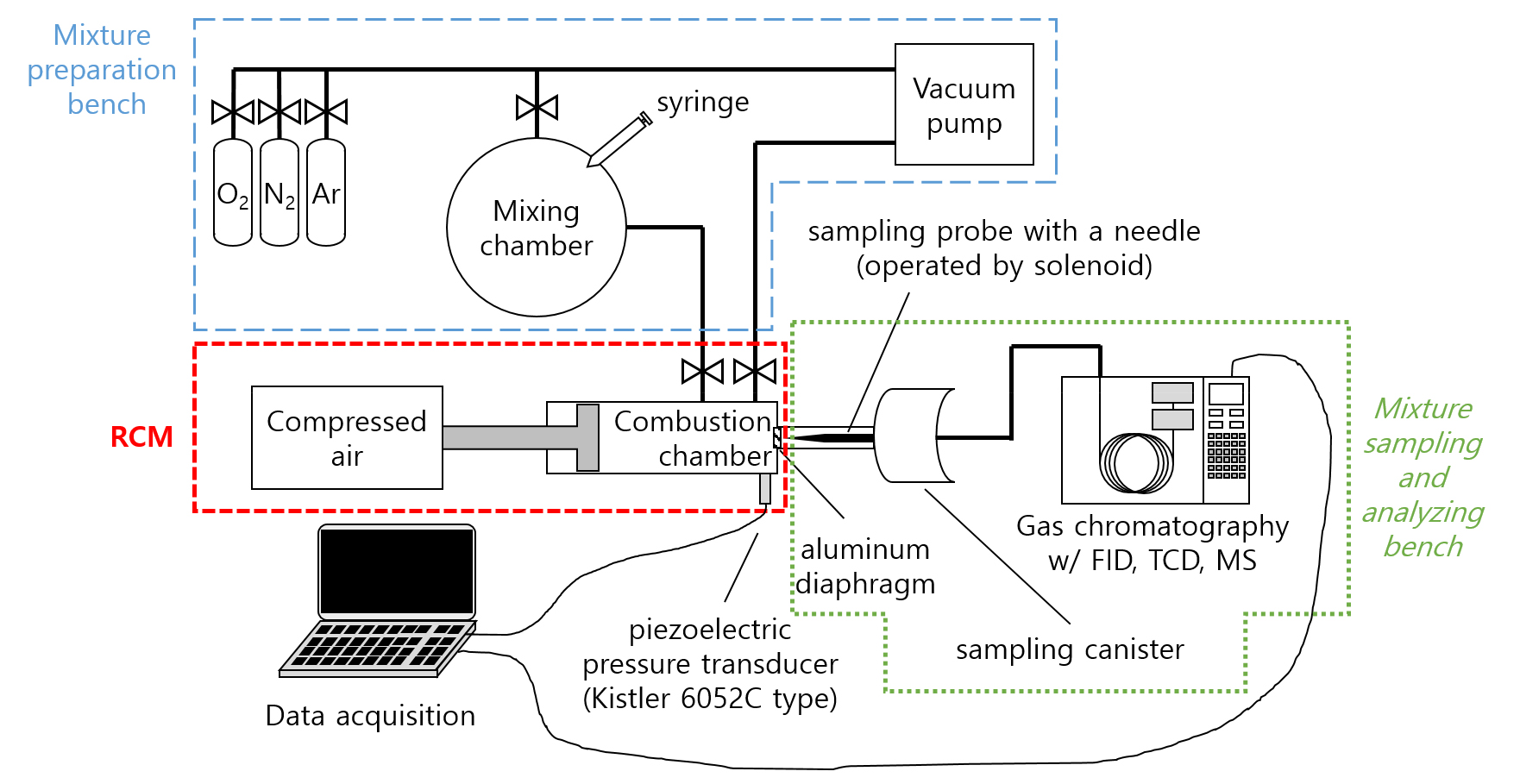
2.1 실험장치
2.2 실험 절차
2.3 급속 열분해 반응 모사
3. 결과 및 고찰
3.1 급속 열분해에 의한 조성 변화
3.2 상세 화학반응 모델을 이용한 실험결과 재현 및 반응경로 분석
3.3 압축 후 열분해 진행 중의 압력 상승 현상
4. 결 론
1. 서 론
대기 중 온실가스 농도 증가에 의한 기후변화의 핵심 원인으로서 난방, 수송, 발전부문 등 인류 활동과 연관된 거의 모든 분야에서 화석연료 사용에 의해 지표 아래에서 대기중으로 새로 더해지는 탄소 공급, 즉 화석연료 사용에 따른 이산화탄소(CO2) 배출이 지적된다[1]. 이에 따라 전세계 약 200여개 국이 참여하여 지구 평균 온도가 산업화 이전 대비 섭씨 2도 이상 상승하지 않게 하고 최종적으로 지구 전체의 이산화탄소 순 배출량을 0이 되도록 한다는 파리협정(Paris Agreement)와 같은 국제 협의 및 상기 협정내용준수를 위해 각 국가별로 다양한 감축목표 설정 및 5년 주기 목표 상향을 의무화하였다[2]. 이 가운데 현 시점에서 가장 대중화된 온실가스 감축 방법 중 하나인 전동화(electrification)의 경우, 에너지 저장의 핵심 요소인 배터리 생산시 필요한 리튬 등의 희토류 광물 채굴 과정에서 발생되는 다량의 이산화탄소, 배터리 자체의 무게로 인한 낮은 에너지 밀도, 배터리 열폭주와 같은 안전성 문제가 최근 대두되면서, 전과정 평가(life-cycle analysis, LCA) 관점에서[3] 산업 전 분야에서의 전동화가 탈탄소사회로 가는 유일한 해결책이 아닐 수 있다는 시각이 점차 확대되고 있다. 따라서 장기적으로는 결국 대기 중의 이산화탄소를 포집, 회수하여 지표면 아래에 저장하거나 전기합성연료(e-fuel)를 생산하여 에너지를 저장하는 등[4] 다양한 이산화탄소 저감 대책이 동시에 진행될 것으로 예상된다.
식물은 일반적으로 생장을 위한 광합성 과정에서 대기 중의 이산화탄소를 흡수하여 탄소는 몸체에 고정하고 산소를 배출하게 되므로, 식물을 대량으로 재배하여 이산화탄소 포집과 같은 기능을 수행할 수 있다. 식물에 흡수된 탄소는 수소 및 산소와 다양하고 복잡한 결합을 이루어 리그닌(lignin), 셀룰로오스(cellulose), 헤미셀룰로오스(hemicellulose)로 대표되는 고분자 형태로 고정되는데, 이를 적절히 처리하여 기존 화석연료를 대체할 수 있는 바이오연료를 생산할 수 있다[5]. 따라서 여러 가지 식물원료를 이용한 바이오연료의 생산과정에서 신재생방식 전력과 추가되는 수소 등을 최대한 활용하는 경우 새로운 탄소를 대기중으로 방출하지 않게 되므로, LCA 관점에서의 탄소중립 달성에 유의미하게 기여할 수 있게 된다.
식물 유래 바이오연료 가운데 가장 널리 사용되는 에탄올의 경우, 높은 옥탄가와 증발 잠열로 인해 불꽃점화 내연기관의 연료로 사용하면 점화시기 진각 및 실린더 내 혼합기 온도 감소의 이점이 있어 널리 사용되고 있다. 유럽연합에서는 10%의 에탄올이 혼합된 RON95급 일반휘발유가 표준으로 공급되며, 미국에서는 풍부한 생산자원의 이점을 가지고 마찬가지로 에탄올이 혼합된 휘발유를 쉽게 찾아볼 수 있다. 브라질의 경우 이보다 더 나아가 에탄올 단독연료, 혹은 85%의 에탄올과 15%의 휘발유로 구성된 E85 연료를 이용하는 flex fuel vehicle이 판매된다. 수송용 연료 성분 중 함산소(oxygenated) 연료로써 에탄올이 널리 사용됨에 따라 이에 대한 기초 연소 연구도 오랜 시간 이어지고 있는데, 주로 자발화 특성이나 화염속도, 입자상 물질 생성 경향 등의 실험결과를 바탕으로 한 상세 화학반응 모델(detailed chemical kinetic model)이 공개된 바 있다[6,7,8].
한편 바이오연료 고도화 및 고품위화, 또는 지속가능한 항공유(sustainable aviation fuel, SAF) 생산을 위한 바이오매스 개질이나 alcohol-to-jet 공정 등을 설계하고 운전할 때에는 무산소 조건에서의 열분해를 주로 이용한다. 특히 에탄올의 경우 다양한 온도 및 압력조건에서 주로 흐름 반응기(flow reactor)나 제트 혼합 반응기(jet-stirred reactor)를 이용한 열분해 실험 결과가 발표된 바 있는데[9,10,11], 주로 석영유리(quartz)를 이용하여 제작하는 위 실험 장비의 특성상 반응 진행 중 발열 반응에 의해 일정 수준 이상의 열 방출이 있을 경우 장비가 파손될 수 있어 연료의 몰분율을 낮게 하고 다량의 비활성기체에 희석된 반응물을 이용한다. 에탄올의 경우 공기 조건에서의 연소 반응시 화학양론에 따른 몰분율은 약 6.54%이나, 위 참고문헌들에서는 이보다 낮은 0.689% [9], 5% [10], 0.3% [11]의 에탄올 몰분율을 이용하였다. 따라서 기존 열분해 관련 연구에서는 혹시 있을 수 있는 반응기 내의 압력 상승이나 온도 상승과 같은 반응물의 발열성(exothermicity)이 상대적으로 높은 비활성기체 분율로 인해 실험적으로 정확히 측정되지 못했을 가능성이 있으며, 그 결과를 바탕으로 화학반응 모델을 개발할 경우 반응물 중 연료의 몰분율이 높은 조성에 대한 열분해 과정을 모사할 때 정확한 결과 재현이 어려울 수 있다. 따라서 본 연구에서는 과정 중 발열 반응에 의한 압력과 온도 상승이 있어도 장비 안정성에 영향을 미치지 않는 실험장치를 이용하여 연료 몰분율이 더 높은 조성에 대한 열분해 실험을 진행하고 그 결과를 해석하였다.
2. 연구 방법론
2.1 실험장치
실험장치는 크게 세 부분으로 이루어져 있으며, Fig. 1과 같이 배치되어 있다. 각 부분별 상세 설명은 다음과 같다.
2.1.1 급속 압축 장치
급속 압축 장치(rapid compression machine, RCM)는 연소실 내에 균일하게 잘 혼합된 연료와 산화제 및 비활성기체의 혼합기를 주입한 다음 수십 ms 수준의 빠른 시간동안 압축하고 체적을 일정하게 유지함으로써 혼합기의 온도와 압력을 높인 상태에서 화학 반응에 의한 자발화(autoignition)가 발생할 때까지 걸리는 시간, 즉 점화지연시간(ignition delay time)을 측정하는 장치이다. 혼합기 생성 및 RCM 압축비와 압축시간 설정등에 따라 다양한 당량비와 희석 정도, 온도 및 압력범위에서 혼합기 조건에 따른 점화지연시간 변화 경향을 측정하여 연소반응을 모사하는 화학반응 모델 개발 및 검증에 활용한다[12].
본 연구에 사용한 RCM은 압축공기를 이용하여 피스톤을 움직이고 유압식 댐퍼를 이용하여 멈추는 작동구조를 갖는다. 압축에 소요되는 시간은 압축공기 압력 설정에 따라 달라지며 일반적으로 200 mm의 피스톤 이동거리를 50 ms 이내에 움직이도록 제어하고 압축비는 필요에 따라 5~20 범위에서 조정할 수 있고 본 연구에서는 압축비 10.27을 유지하였다. 압축 후에는 피스톤이 반대방향으로 되돌아가지 못하도록 홈이 파진 캠을 이용하여 압축 후 연소실 체적이 정적상태를 유지하도록 구현되어 있다. 연소실의 초기 온도는 전기저항식 발열체를 이용하여 설정하며 본 연구에서는 초기온도를 섭씨 75°C로 유지하였다. 연소실 내 압력변화는 압전소자 방식의 Kistler 6052C 압력센서를 이용하여 25 kHz로 기록하였다. 보다 자세한 사항은 참고문헌[13]에 상세히 기술되어 있다.
2.1.2 혼합기 제작 장치
혼합기는 표면반응을 억제하기 위해 석영유리로 제작된 20 L 크기의 구형 용기 내부를 1 torr 미만의 진공으로 만든 후, 액체연료 주입을 위한 주사기 연결구를 통해 액체 주입 시 증발에 의한 연료분압을 측정하여 필요한 연료량을 주입하고, 이후 기체 주입을 위한 전용 피팅을 갖춘 연결구에 고순도(99.999% 이상) 기체를 연결하여 마찬가지로 분압 측정에 의해 주입하여 제작하였다. 필요에 따라 장치 전체를 가열상태로 유지하여 증기압이 낮은 연료 사용시에도 증발이 원활하게 이루어질 수 있도록 하였으며, 본 연구에서는 에탄올(≥95%, Sigma-Aldrich):질소:아르곤의 몰비율을 1:3:11.28로 혼합한 혼합기를 사용하였다. 혼합기 제작 완료 후 최소 6시간 이상 가열된 상태로 방치하여 용기 내부의 혼합기 분포가 균일한 상태가 되도록 하였다.
2.1.3 시료 채취 및 분석 장치
본 연구에 사용한 RCM의 경우 점화지연 기간 중 연소실 내에서 반응이 진행중인 혼합기 시료를 채취하여 탄화수소 및 수분, 일산화탄소, 질소, 아르곤 등을 정량적ㆍ정성적으로 분석할 수 있다. 이를 이용하여 점화지연 기간 중 연료의 감소 및 연소 중간생성물, 전구체 등의 생성 경향을 시간의 흐름에 따라 측정할 수 있어 연소 화학반응 모델 개발 및 검증시 유용한 자료로 사용할 수 있다. 시료 채취는 전자석에 의한 니들 밸브로 사용자가 원하는 시점에 시료 채취구를 막고 있는 알루미늄 막을 뚫어 연소실 내에서 화학반응이 진행중인 혼합기가 약 40배 이상의 부피로 단시간 내에 단열팽창하게 함으로써, 진행중인 화학반응을 1 ms 이내에 중단하여 화학조성을 유지하고 즉시 가스 크로마토그래피(gas chromatography, GC)에 주입하여 분석하였다. 시료 채취시 팽창에 따른 압력 급감은 동일한 RCM을 사용한 기존연구[14]에서 Fig. 2와 같이 그 예시를 확인할 수 있다. GC는 열전도도 검출기(thermal conductivity detector, TCD)와 불꽃 이온화 검출기(flame ionization detector, FID), 그리고 정성분석을 위한 질량 분석기(mass spectrometer, MS)가 장착되어 시료 구성성분의 정량분석과 정성분석이 모두 가능하다.
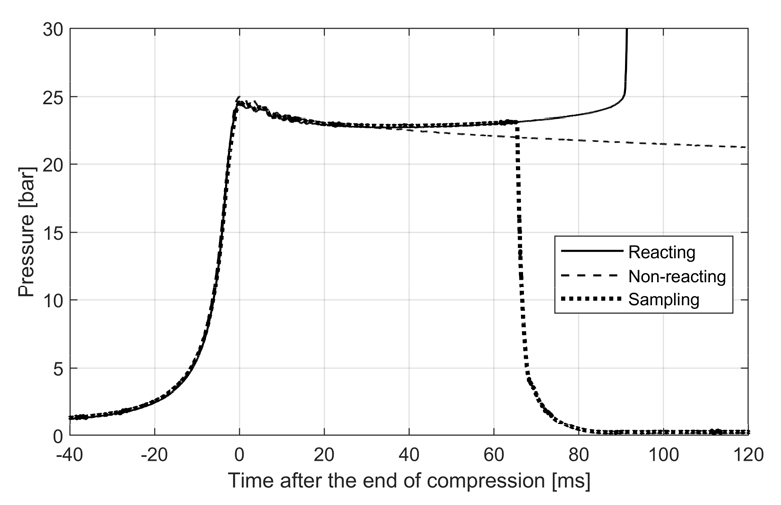
Fig. 2.
Representative pressure profiles during an RCM experiment[14], showing pre-ignition exothermicity and autoignition event (solid), slow pressure decrease of the non-reacting mixture (dashed), and the steep pressure drop of the reacting mixture sampling near 65 ms, due to the sudden expansion of the compressed gas to the sampling canister (dotted).
2.2 실험 절차
실험은 다음과 같은 순서로 진행된다.
① 먼저 혼합기 제작 장치를 이용하여 에탄올/질소/아르곤 혼합기를 만든다.
② RCM 연소실 초기온도를 설정하고 피스톤을 후퇴 고정시킨 후, 진공펌프를 이용해 연소실 내부를 1 torr 미만의 진공으로 유지한다.
③ 진공펌프 연결밸브를 닫고 절대압 센서로 압력을 측정하면서 필요한 양의 혼합기를 주입한다.
④ 혼합기 주입구를 닫고 후퇴 고정된 피스톤 구동부의 압축공기를 해제하여 피스톤을 빠르게 전진시켜 RCM 연소실 내에 주입된 혼합기를 급속 압축한 뒤 유지한다. 본 연구에서와 같이 10.27의 압축비를 설정했을 경우, 압축 완료 시점에 RCM 연소실 내부의 부피는 약 43 cc 이다.
⑤ 시료 채취구를 포함한 시료 포집장치의 절대압력 1 torr 미만의 진공을 유지한 상태에서, 피스톤 압축완료 후 정적상태에서 원하는 시점에 제어 신호를 이용하여 스프링과 전자석에 의해 고정된 시료 채취용 니들 밸브 구동부의 전류를 해제하면, 스프링 팽창에 의해 니들 밸브가 빠르게 발사되면서 RCM 연소실과 시료 채취구 사이를 막고 있는 알루미늄 막을 파괴한다. 이때 RCM 연소실 내부에서 반응이 진행되고 있던 고온 고압 상태의 혼합기는 순간적으로 약 1.75 ℓ 의 시료 채취 캐니스터[15]로 단열팽창하며 온도와 압력이 급감, 화학반응이 중단되고 조성이 보존된다.
⑥ 진행중이던 반응이 중단된 채로 획득한 시료를 즉시 GC에 주입하여 TCD에서 질소와 산소, 아르곤, 일산화탄소를 정량측정하고 FID에서 탄화수소를 정량측정하며, 동시에 MS에서 측정된 화학종을 정성분석한다.
2.3 급속 열분해 반응 모사
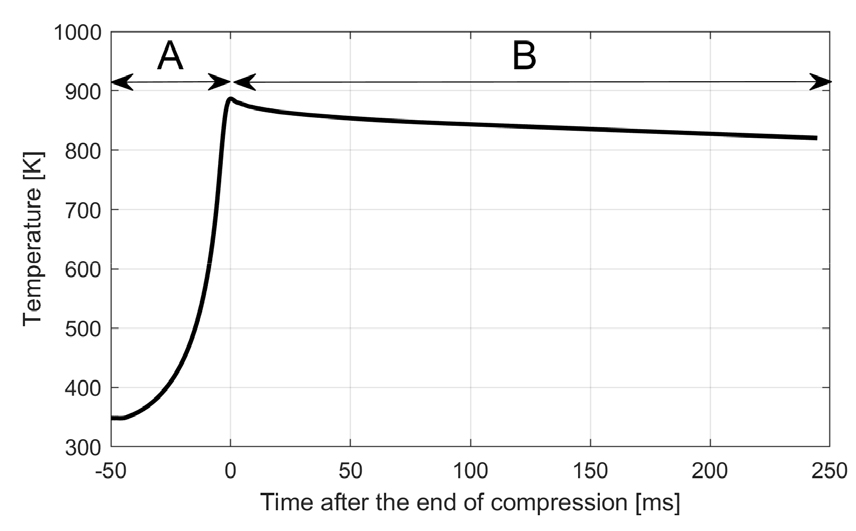
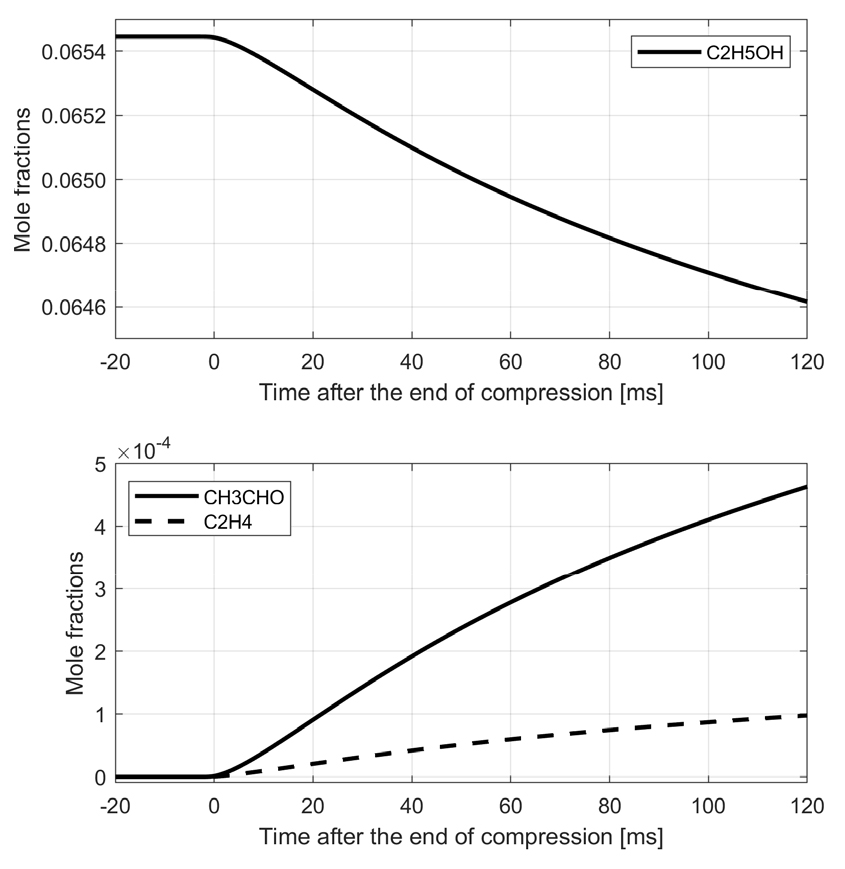
RCM 연소실 내부의 열역학적 상태 변화를 모사하기 위하여 측정된 압력-시간 측정결과와 조성을 이용하고 이상기체로 가정하여 단열압축과정을 적용하였으며, 온도에 따른 비열비 변화를 반영하기 위해 단위시간별로 측정된 압력변화와 압축 시작 시점에서의 비열비 값을 초기값으로 하여 온도-시간 추세를 구하였다. 압축 종료 시점 이후 연소실 체적은 정적상태를 유지하지만 기체에서 연소실 벽면으로의 열전달에 의해 기체의 온도와 압력은 조금씩 떨어지는데, 일반적으로 RCM 실험에서는 이를 시뮬레이션에 반영하기 위해 혼합기의 산소를 열적 물성치가 유사한 질소로 대체한 비반응성 혼합기를 따로 만들어 압축과정 및 압축 후 열전달 과정에서 감소하는 압력-시간을 측정한 후, 이를 실린더 내의 부피가 증가하는 것으로 대체하는 유효 체적법(effective volume method[12])을 이용하여 모사한다. 본 연구에서도 같은 방법론을 적용하여 Python 환경에서 Cantera[16]를 이용하여 압축종료 이후의 연소실 내 온도 감소를 모사하였으며, 계산 결과 온도는 압축종료 시점에서 약 880 K에 이르며 이후 Fig. 3에서와 같이 300 ms 동안 약 60 K 정도 감소하는 것으로 나타난다.
에탄올의 급속 열분해를 모사하기 위한 상세 화학반응 모델로는 최근 발표된 에탄올의 RCM 내 자발화 관련 연구인 Büttgen 모델[17]을 사용하였다. 해당 모델은 100개의 화학종과 622개의 반응식으로 이루어져있다.
3. 결과 및 고찰
3.1 급속 열분해에 의한 조성 변화
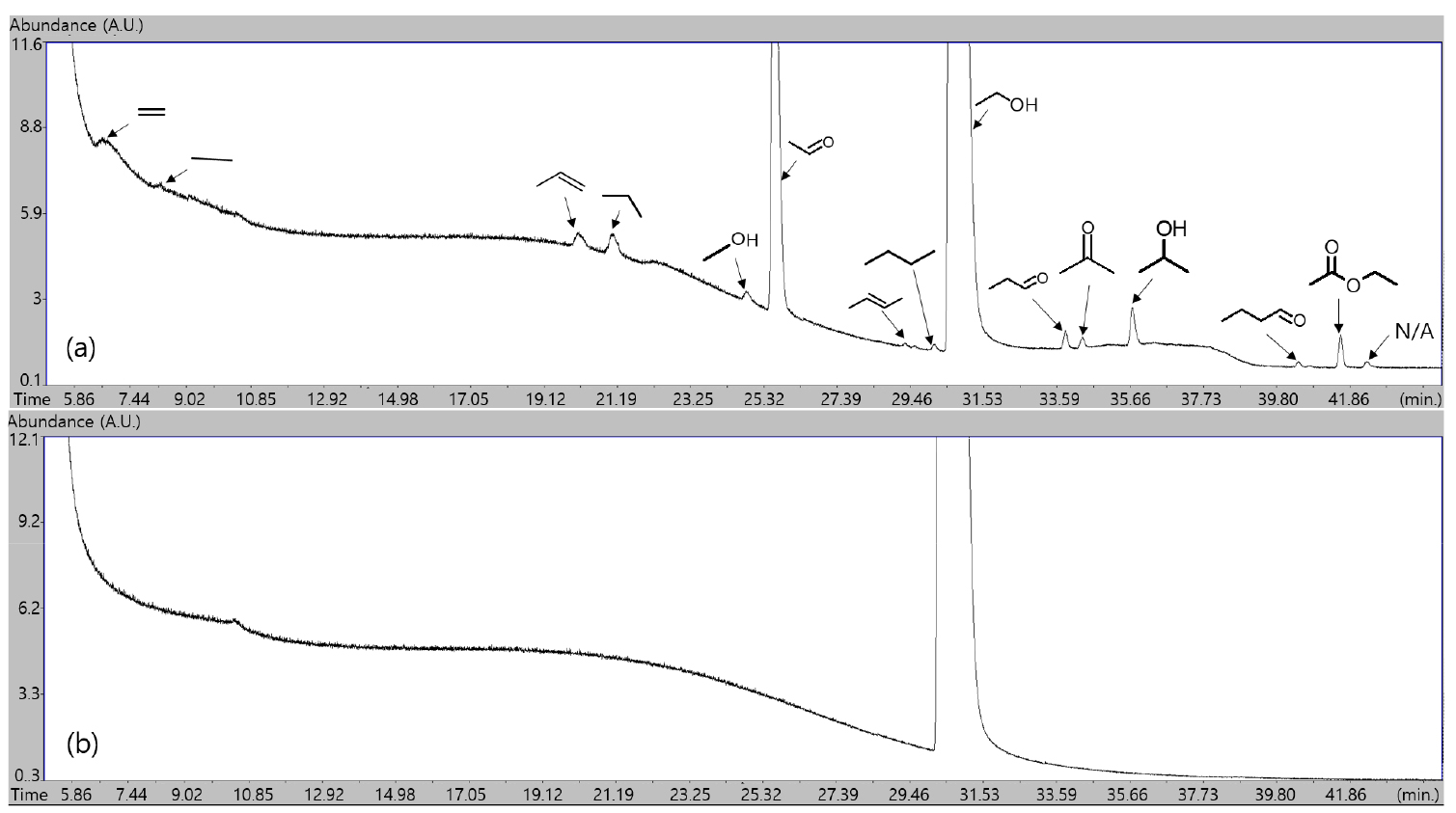
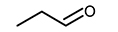
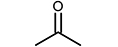
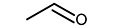
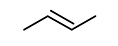
에탄올-질소-아르곤으로 이루어진 비반응성 혼합기를 압축시켜 압축 후 온도 875 K, 20 bar에 도달한 후 약 50 ms 경과한 시점에서 연소실 내 혼합기를 채취하여 가스 크로마토그래피에 주입하여 조성을 측정하였으며, retention time 증가에 따라 순서대로 Fig. 4(a)와 같이 추출되었다. 표시된 각 화학종에 대한 정보는 Table 1에서 찾아볼 수 있다. 해당 시점에 연소실 내 조건은 약 850 K, 19 bar 상태이다. RCM 주입 전 초기 비반응성 혼합기에 상기 3가지 성분 이외에 다른 불순물이 포함되어 있지 않음을 검증하기 위해 동일한 비반응성 혼합기를 혼합기 제작 장치에서 바로 취하여 동일한 가스 크로마토그래피 온도 프로파일을 적용하여 분석하였으며, 그 결과 Fig. 4(b)와 같이 FID 측정결과로부터 에탄올 이외의 다른 탄화수소가 포함되지 않았음을 알 수 있다. 또한 TCD 측정결과로부터 질소와 아르곤 이외의 다른 기체는 존재하지 않음을 확인하였다. 따라서 실험에서 측정된 아세트알데하이드(CH3CHO), 에틸렌(C2H4), 에테인(C2H6) 등의 화학종들은 모두 급속 열분해 과정에서 나타났음이 확인된다. 본 연구와 유사한 온도 및 압력 조건에서 수행된 에탄올 열분해 관련 기존 연구결과들[9,10,11]에서 흐름 반응기나 제트 혼합 반응기를 사용하여 훨씬 긴 residence time 동안 혼합기를 반응기 내에 머무르게 하는 것과 달리 RCM 내부에서 상대적으로 50 ms 정도의 짧은 시간이 흘렀음에도 불구하고 위와 같은 화학종들이 공통적으로 나타나는 것으로 보아, 본 연구와 같이 RCM을 이용하면 연료 몰농도가 높은 고압 조건에서의 급속 열분해 반응을 유도할 수 있으며, 해당 조건에서의 실험결과를 상세 화학반응 모델 개발에 추가로 활용할 수 있을 것으로 예상된다.
Table 1.
Identified species from the sampled mixture. Sample acquired at 50 ms after the end of piston compression
3.2 상세 화학반응 모델을 이용한 실험결과 재현 및 반응경로 분석
앞에서 실험적으로 그 존재가 입증된 화학종들이 실제로 본 연구에서의 압축 후 온도 조건과 압력 조건에서 에탄올의 열분해에 의해 발생할 수 있는지 확인하기 위해, Büttgen 모델을 이용하여 비반응성 혼합기 조성을 설정하고 RCM 실험을 모사하였다. 실험에서 측정된 화학종들 가운데 화학반응 모델 내에 포함된 CH3CHO와 C2H4의 경우를 비교한 결과, Fig. 5에 제시된 것과 같이 상대적으로 저온·고압 조건이며 짧은 반응시간이 흘렀음에도 불구하고 급속 열분해 과정이 개시되어 화학종 생성이 시작되었음을 확인할 수 있다.
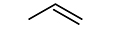
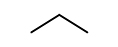
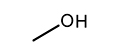
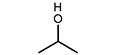
에탄올 분자 구조를 이루는 여러 원자간 결합 중 열분해에 의해 결합이 깨질 수 있는 경로는 일반적으로 다음과 같은 세 가지 경로가 제시된다[18].
따라서 R1에 의해 C2H4의 생성이 가능하며, R2와 R3에 의해 연쇄반응의 매개체인 메틸(CH3) 라디칼과 수산화(OH) 라디칼이 생성되어 반응에 참여하게 된다. 초기에 생성된 CH3와 OH는 각각 다음과 같이
의 반응에 의해 에탄올 분자로부터 수소원자를 한 개 제거한다. 위에서 X는 CH3 또는 OH에 해당한다. 이때 형성된 3종류의 에탄올 라디칼로부터 다양한 화학종들이 생성될 수 있으며, 이에 해당하는 반응경로들과 실험에 의해 측정된 화학종들은 Fig. 6에서 확인할 수 있다.
한편 실제 실험에서는 10여종의 화학종이 측정된 반면, Büttgen 모델이나 이 모델의 근원인 Mittal 모델[7]에는 대부분의 생성 경로가 포함되어 있지 않아 시뮬레이션을 이용한 결과 예측에 한계가 존재한다. 따라서 본 실험 결과를 토대로 화학반응 모델 내에 존재하지 않는 화학종들의 생성이 가능한 경로를 예상해볼 수 있으며, 산소가 없는 열분해 조건이므로 반응에 참여할 수 있는 라디칼은 H와 CH3가 주를 이루며, 에탄올 구조상 OH 또한 일부 형성되어 반응에 참여할 수 있다. 이러한 점들을 고려하여 가능할 것으로 예상되는 화학 반응 경로들을 Fig. 6에 회색 이중실선 화살표로 나타냈다. Fig. 4의 FID 측정결과로부터 CH3CHO가 상당량 생성되었음을 고려하고 탄소 위치에 따른 에탄올 분자구조 내 C-H 결합 에너지의 차이를 감안하면 R5로부터 연쇄적으로 진행되는 CH3CHO 반응 경로가 주요 경로일 것으로 생각할 수 있고, 이로부터 프로판알 및 부탄알, 아세톤, 에틸 아세테이트의 생성 또한 수소와 메틸기, 또는 에탄올 라디칼의 반응 참여로 가능할 것으로 예상된다. 특히 에틸 아세테이트의 생성은 에탄올 존재 조건에서 CH3CHO의 탈수소 반응에 의한 것임이 이미 잘 알려져 있으며[19], 본 연구에서 측정된 결과도 이와 유사한 반응 경로가 열분해 과정 중에 진행될 수 있음을 암시한다. 다만 보다 정확한 반응 경로 선정 및 반응 계수 결정을 위해서는 추후 화학반응론에 기반한 이론적 연구와 관련 기초 연소 실험 등이 폭넓게 진행되어야 할 것으로 생각된다.
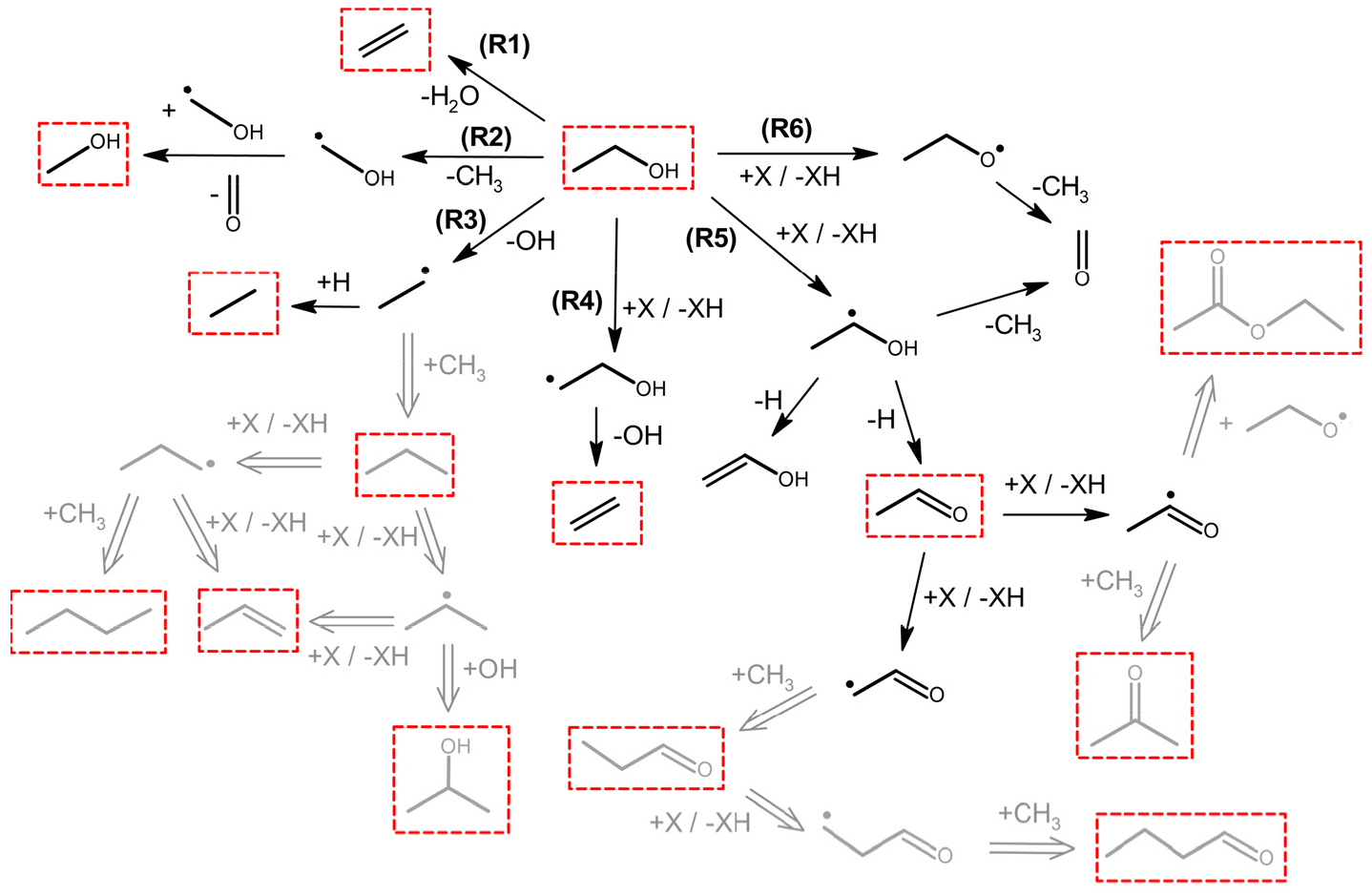
Fig. 6.
Possible reaction pathways of ethanol pyrolysis under high pressure conditions, based on the experimentally observed intermediate species highlighted with a red dashed box. Black arrows and black symbols indicate the reaction pathways and species already present in the Büttgen model [17], while gray double arrows and gray symbols stand for the proposed reactions and species based on this study, but not included in the Büttgen model.
3.3 압축 후 열분해 진행 중의 압력 상승 현상
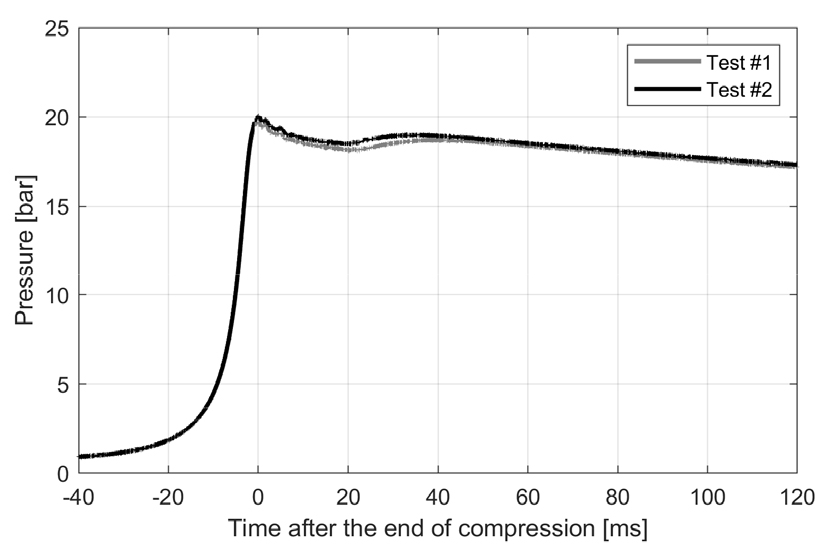
실험에서 관찰된 독특한 현상으로, 산소가 혼합기에 포함되어 있지 않음에도 불구하고 압축 후 약 30 ms 근방에서 약한 압력 상승이 나타나는 것을 Fig. 7과 같이 확인하였다. 일반적으로 지금까지 알려진 열분해 현상에서는 밀폐된 계의 압력 상승, 즉 발열성(exothermicity)이 관찰되지 않기 때문에, 혼합기 제작 과정, 혹은 실험 진행 과정 중 공기가 섞여 들어갔을 가능성을 배제하기 위하여 서로 다른 날짜, 다른 시간대, 다른 로트 번호를 갖는 에탄올 사용 등 다양한 변수를 모두 고려하였음에도 불구하고 압력 상승 현상은 압축 후 온도와 압력이 동일하다면 항상 같은 시점에 같은 정도로 관찰되었다. 또한 3.1절에서 언급한 것과 같이 혼합기의 조성을 분석했을 때 산소는 어떠한 경우에도 GC/TCD에서 검출되지 않았다. 따라서 이 현상은 산소가 관여하는 연소 현상과는 달리, 실제로 열분해 과정의 진행 동안에 어떠한 이유로든 주요 화학반응 경로 중 발열반응이 포함되어 있음을 암시한다. 화학반응 모델을 이용한 시뮬레이션에서는 해당 현상이 재현되지 않았으며, 이는 서론에서 언급한 바와 같이 화학반응 모델 개발시 해당 내용이 반영되지 않았기 때문으로 생각된다. 반면 본 연구에서와 같이 급격한 압력 상승 조건에서도 측정 가능한 RCM과 같은 장비를 이용하여 희석정도가 낮은 혼합기의 열분해 실험을 수행할 경우, 반응 과정 중 열방출이 있을 때에 이를 실험적으로 정확히 측정할 수 있으므로, 열분해 과정을 보다 정확히 모사할 수 있는 상세 화학반응 모델 개발에 중요한 기반 데이터를 획득하는 데에 도움이 될 것으로 생각된다.
4. 결 론
본 연구에서는 RCM을 이용하여 에탄올과 비활성기체의 혼합기를 초기상태에서 빠르게 압축시켜 온도와 압력을 상승시킨 후, 수십 ms 정도의 짧은 시간 경과 후 급속 열분해 반응이 일어나는 것을 실험적으로 계측하고 반응물 시료를 채취하여 가스 크로마토그래피 분석을 통해 열분해 과정에서 나타나는 여러 화학종을 추적하였다. 분석 결과 기존 에탄올 열분해 관련 연구에서 언급된 아세트알데하이드, 에틸렌, 에테인 등이 계측되었으며, RCM 조건에서의 급속 열분해 실현 가능성을 확인하였다. 또한 기존 연구에서는 언급되지 않는 프로판알, 프로페인, 프로펜, 아세톤 및 에틸 아세테이트 등이 에탄올의 열분해 과정에서 다량 발생하는 수소, 메틸기, 에탄올 라디칼의 반응 참여에 의해 충분히 가능함을 제시하였다. 보다 정확한 반응과정 모사나 해석을 위해서는 추후 화학반응론적 이론연구와 관련된 기초 실험 결과가 반영되어야 할 것으로 생각된다. 또한 일반적인 열분해 과정에서 잘 나타나지 않는 발열성이 나타났으며, 이는 기존 열분해 실험의 한계점을 시사함과 동시에 열분해 과정을 정확히 모사할 수 있는 상세 화학반응 모델 개발에 있어서 비활성기체 희석정도가 낮은 혼합기 조건에서의 실험 결과가 포함되어야 함을 암시한다.