1. 서 론
2. 이론적 모델
2.1 가스 연소 장치 모델
2.2 암모니아 분해 튜브 모델
3. 수치해석 조건
3.1 가스 연소 장치 해석 조건
3.2 암모니아 분해 튜브 해석 조건
4. 결과 및 고찰
4.1 가스 연소 장치 해석 결과
4.2 암모니아 분해 튜브 해석 결과
4.3 암모니아 분해 반응기 설계 인자 도출
5. 결 론
1. 서 론
2019년 발표된 「수소경제 활성화 로드맵」을 필두로 수소 중심의 국가경제, 사회전반 및 국민생활 등에 근본적인 변화를 초래하여 경제성장과 친환경 에너지의 원천이 되는 경제가 제시된 이후, 2022년 11월 제5차 수소경제 위원회를 통해 「수소기술 미래전략」이 발표 되었다. 국내 수소산업 육성 정책 방향은 3대 성장(3UP) 전략으로, 그중 발전·수송 분야에서 대규모 수소 수요를 창출하는 Scale UP 전략은 국내 그레이 수소 생산 시설을 국내외 대규모 청정수소 생산기지 구축으로 전환하는 내용이 담겨있다. 이는 Build UP 전략에서 수소유통 전략으로 제시된 암모니아·액화수소 인수기지 건설 및 인프라 구축과 긴밀히 연관을 짓고 있으며, 유동된 암모니아의 수소 전환이 포함되어있다.
국내 수소 공급은 부생수소, 추출수소, 수전해 생산 수소 그리고 해외공급을 통해 이루어지는데, 2040년까지 526만톤을 공급하되, 이중 추출 수소는 30%, 부생수소와 수전해, 해외생산 수소를 70% 비율로 공급하는 것을 목표로 두고 있다. 수소 저장 및 운송 방법[1]으로는 수소의 직접 액화를 통한 운반(LH2, Liquid Hydrogen), 액상 유기수소 운반체로의 변환(LOHC, Liquid Organic Hydrogen Carriers), 수소의 암모니아 변환(NH3) 방식이 논의되는 실정이며, 각각의 수소 저장 형태에 관한 내용은 Table 1과 같다.
Table 1.
LH2의 경우 복합 진공 단열 기술을 이용하며, 기체 저장 방식과 비교하여 약 1.75배 더 많은 수소 저장이 가능하지만, 액화를 위한 냉각 손실(약 45%), 저장, 누출 및 증발 손실과 수소 재변환 손실을 모두 고려하여야 하며 검증된 수소 공급 인프라가 없는 실정이다[5, 6, 7]. LOHC의 경우 수소에서 운반체로의 변환 비용은 액화수소나 암모니아 전환 비용의 절반이지만, 다시 수소로 재변환 시 소요되는 비용은 매우 높은 수준으로 알려져 있다[8]. 암모니아의 경우 수소화 비용은 LOHC에 비해 상대적으로 낮은 수준이며, 기존 암모니아 수송/저장 인프라를 활용할 수 있다는 장점을 갖고 있으며, On-site 운송이 가능하다는 이점이 있다. 또한 암모니아의 경우 최종적으로 활용/전환 가능한 수소가 약 76%로 수소의 대량·장기 저장 및 운송에 최적화 된 연료 및 물질로 고려될 수 있다[8, 9].
암모니아 분해 반응은 촉매를 적용하여 반응온도 영역대를 낮춰 에너지 절감효과를 달성할 수 있으며, 특히 귀금속인 Ru(Ruthenium) 기반 촉매는 활성화 에너지를 93.47 kcal/mol에서 31 kcal/mol 수준까지 낮출 수 있는 것으로 보고된다[10, 11, 12, 13].
이와 같이 수소 저장 및 운송 방법으로 암모니아의 활용이 고려되는 추세에서 암모니아의 수소 재전환 효율이 극대화될 필요가 있다. 한국에너지기술연구원의 경우 2019년부터 2021년도까지 20 Nm3/hr급 고순도 수소생산 시스템 개발을 수행하였으며, Ru 촉매를 사용하여 암모니아 분해 후 미분해 암모니아와 질소를 분리하기 위해 PSA 시스템을 적용하였다[5]. 한국과학기술연구원은 Ru/La-Al2O3 촉매와 Pd/Ta 복합 분리막을 적용한 시스템을 구축하여 450°C에서 순도 99.99% 이상 수소생산 및 암모니아 전환율 99% 이상의 실험실 규모 성능을 확보하였다[14]. Maleki의 연구에 따르면, CoCeAlO혼합 산화물 촉매를 적용한 flat- plate microreactor에서 kinetic parameter 실험을 수행하여 암모니아 분해 반응 인자를 CFD 모델링에 적용하는 연구를 수행하였으며, 이는 암모니아 분해 반응기 kinetic을 효과적으로 예측하는 것에 활용 가능하다고 보고된다[15]. Chiuta의 연구에 따르면, Ru 기반 구조체 촉매를 사용하여 micro-channel reactor에서의 CFD 시뮬레이션과 실험적 검증을 통하여 반응 영역 내에서 물질전달 영향을 평가하고 암모니아 분해 반응기의 효율적인 설계 데이터를 제시할 수 있다는 것을 증명하였다[16].
본 연구에서는 ANSYS fluent 2020 R1을 사용하여 수소 운반체로 활용되는 암모니아를 분해하여 고순도 수소 생산을 위한 5 Nm3/hr급 암모니아 분해 장치의 전산해석적 연구를 진행하여, Ru 기반 촉매가 적용된 암모니아 분해 튜브에 대한 영향도를 파악하고 가스 연소 장치의 열전달 효율을 평가하였다.
2. 이론적 모델
2.1 가스 연소 장치 모델
암모니아 분해 튜브 내부 반응 유도를 위한 가스 연소 장치 내부 온도를 모사하기 위해 아래와 같이 에너지 평형 모델 및 열전달 모델을 적용하였다. 에너지 평형 및 열전달 모델은 각각 가스 연소 장치 내부에서의 공급 연료 열량과 열량 손실을 정의하였으며, 질량(식 (1)), 모멘텀(식 (2)), 에너지(식 (3)) 그리고 화학종(식 (4))에 대한 보존방정식을 아래 식과 같이 나타내었다.
천연가스 연소과정은 Eddy-dissipation-concept(EDC) 모델을 통하여 예측하였으며, 화학종의 반응속도는 식 (5), (6)과 같이 정의된다.
여기서, *은 미세 난류 구조(fine scale)에서의 상태량을 나타내는 지표이며, volume fraction , time scale 에 의해 화학반응이 결정된다.
연소 장치 내부에서는 빠른 속도로 분사되는 가스들의 유동에 의해 강한 난류가 형성된다. 난류 유동은 공기와 천연가스 반응 외에도 많은 화학종들의 혼합과 그에 따른 반응에 의해 지배된다. 난류는 높은 Reynolds 수를 가지는 유동에서 관찰되는 삼차원의 비정상 무작위 운동이다. 이는 Navier-Stokes 방정식에 의해 설명되며, 방정식에 Reynolds averaging을 적용하게 되는데 이 방정식을 Reynolds-Averaged Navier-Stokes(RANS) 방정식이라고 한다. 이러한 가정을 통해 유동의 모든 난류 구조는 제거되며, 평균 속도의 매끄러운 변동과 압력장을 얻을 수 있다. 이때 Reynolds averaging으로 인해 추가적인 미지수 항(Reynolds stress)이 나타나게 되는데 이를 계산하기 위해 적절한 난류 모델 선택이 필요하게 된다. RANS의 대표적인 모델로 k-ε과 k-ω 모델이 있다. 두 모델은 두 개의 추가적인 수송방정식(Transport equation)의 해와 Reynolds stress를 계산하기 위해 Eddy viscosity를 도입한다. RANS 모델 중 더 복잡한 모델인 RSM(Reynolds Stress Model)은 Scale equation(ε-equation 또는 ω-equation)이 추가된 여섯 개의 독립적인 Reynolds Stress 방정식을 직접 계산한다. 보편적으로 사용할 수 있는 모델은 없으므로, 주어진 조건에 가장 적합한 모델을 결정해야 한다. 그중 k-ε Model은 두 개의 방정식을 푸는 모델로서 산업 시스템의 CFD에서 가장 넓게 사용되는 모델이다. 특히 대부분의 연소 시스템에 관한 전산해석에서는 k-ε 모델이 사용되고 있으며, 본 연구에서도 Realizable k-ε 난류 해석 모델이 적용되었다. 복사 열전달 모델은 DO(Discrete Ordinates) 모델이 사용되었으며, 이는 혼합물에 대해 사용할 수 있으며 혼합물의 흡수 계수, 굴절률, 산란 계수는 개별 상의 복사 특성에 대하여 체적 분율 평균을 토대로 계산한다.
2.2 암모니아 분해 튜브 모델
암모니아 분해 튜브에서의 암모니아의 난류 유동 모델은 가스 연소 장치에서 사용된 모델과 동일한 Realizable k-ε 난류 해석 모델을 적용했다.
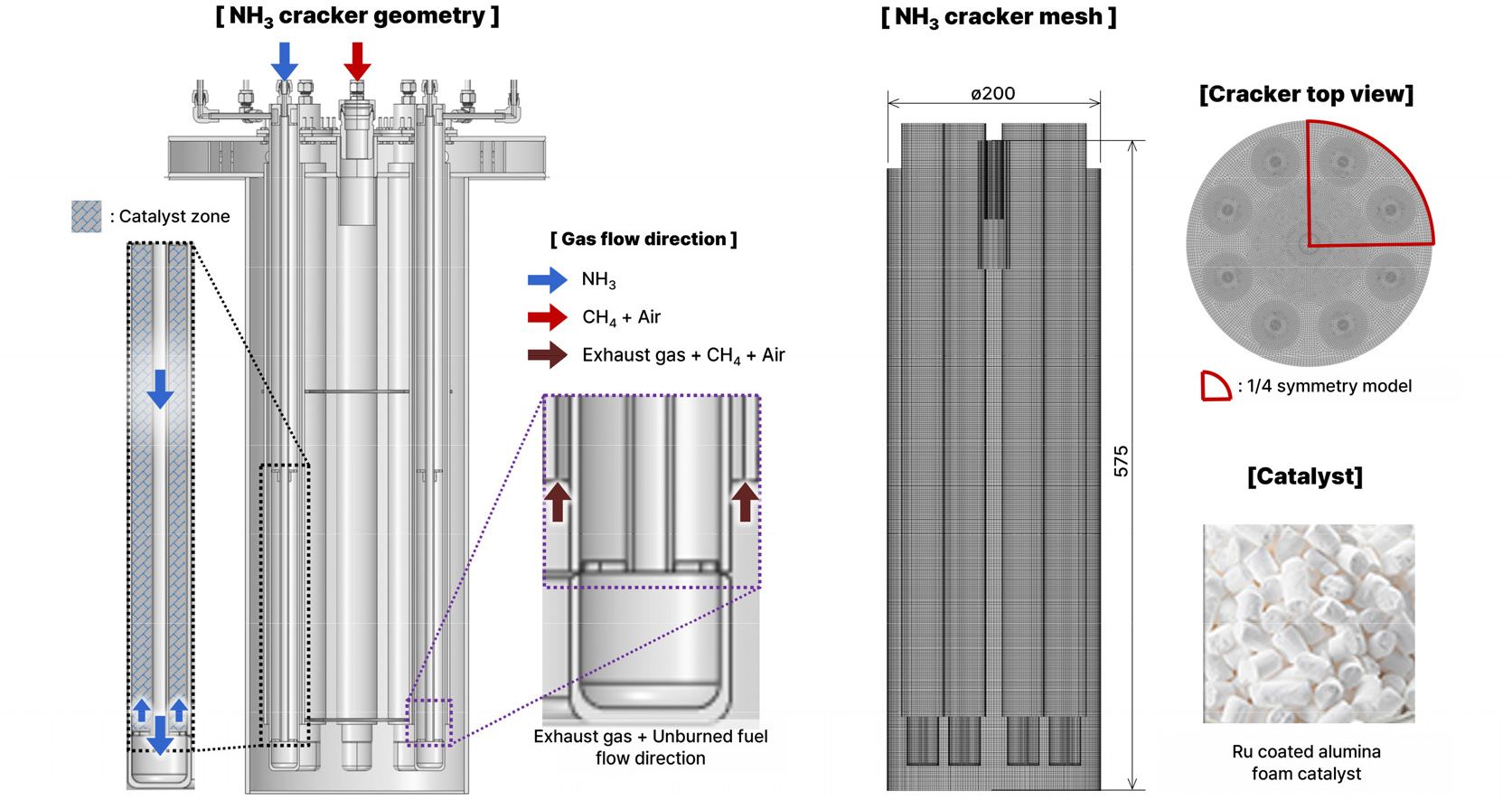
암모니아 분해 튜브 내부에는 촉매층과 비촉매층이 약 3:7의 비율로 구성되어 있다. 본 연구에서 사용된 촉매는 원기둥의 모양인 알루미나 구조체 형태의 Ru/Al2O3 촉매로 구성되었다고 설정하였다. 또한 전산해석의 단순화를 위하여 촉매층은 고정되어 있는 다공성 영역(Porous zone)으로 가정하였다. 이곳을 지나는 유동의 모멘텀 손실은 고정층에서의 공극률에 따른 유동속도와 저항의 관계식인 Ergun Equation을 사용하여 표현하였으며, 그에 따른 식은 다음과 같다.
이때 촉매층 내부에 3.2 mm의 반지름을 높이 3.2 mm 원기둥의 형태의 팰릿이 들어있다고 가정했으며 공극률은 선행논문을 참고하여 0.59로 설정하였다[17]. 촉매층 영역에서 촉매의 열전달 계수 및 물성은 아래 Table 2와 같이 설정하였다.
3. 수치해석 조건
3.1 가스 연소 장치 해석 조건
전산해석에 사용된 가스 연소 장치의 3차원 형상을 Fig. 1과 같이 나타내었다. 반응기 내부 형상은 천연가스 연소가 발생하는 장치와 암모니아 분해가 일어나는 장치인 분해 튜브로 나눠진다. 시스템 내부에 천연가스와 공기를 주입하여 발생한 확산화염으로 인한 복사열과 연소 가스의 순환으로 인해 발생한 대류열이 출구로 빠져나가면서 암모니아 분해 튜브로 열이 전달되는 형태이다. 암모니아 분해 튜브는 원점을 기준으로 90°의 회전주기로 형상이 반복되는 구조를 가지므로, 계산비용을 줄이기 위하여 주기적으로 형상이 반복되는 영역에 대해 고려 가능한 periodic 방식으로 1/4영역에 대해 260만개의 격자를 생성하여 해석을 수행하였다.
가스 연소 장치에서는 천연가스가 연료로 사용되었다. 해석 시 암모니아 분해 반응 내부 온도가 823 K(550 °C) 이상 수준으로 유지될 수 있도록 연료 유량을 설정하였으며, 압력 및 유량 조건을 Table 3과 같이 나타내었다.
해석에 사용된 화학 반응식은 연소 해석에서 가장 많이 활용되고 있는 Jones- Lindstedt 4-step mechanism에 따른 식(식 (8), (9), (10), (11))[18], Carbon monoxide 연소식(식 12)을 사용하였다[19].
Table 3.
Operating conditions of gas burner
| Burner conditions | Properties | ||
| Pressure [atm] | 1 | ||
| Gas flow rate | Air | [LPM] | 53.9 |
| [kg/s] | 2.75×10-4 | ||
| CH4 | [LPM] | 4.9 | |
| [kg/s] | 1.36×10-5 | ||
3.2 암모니아 분해 튜브 해석 조건
암모니아 분해 튜브에서 사용된 펠렛 타입의 촉매를 모사하기 위해 촉매 영역은 porous media로 가정되었다. 분해 튜브에 사용된 암모니아는 약 9 atm의 조건에서 3.45×10-5 kg/s의 유량으로 주입되었다. 분해 튜브 해석에 있어서 사용된 반응식은 촉매를 적용한 경우와 촉매 없이 운전되는 경우에 대해 각각 다른 화학식을 사용하여 해석을 진행하였다.
4. 결과 및 고찰
4.1 가스 연소 장치 해석 결과
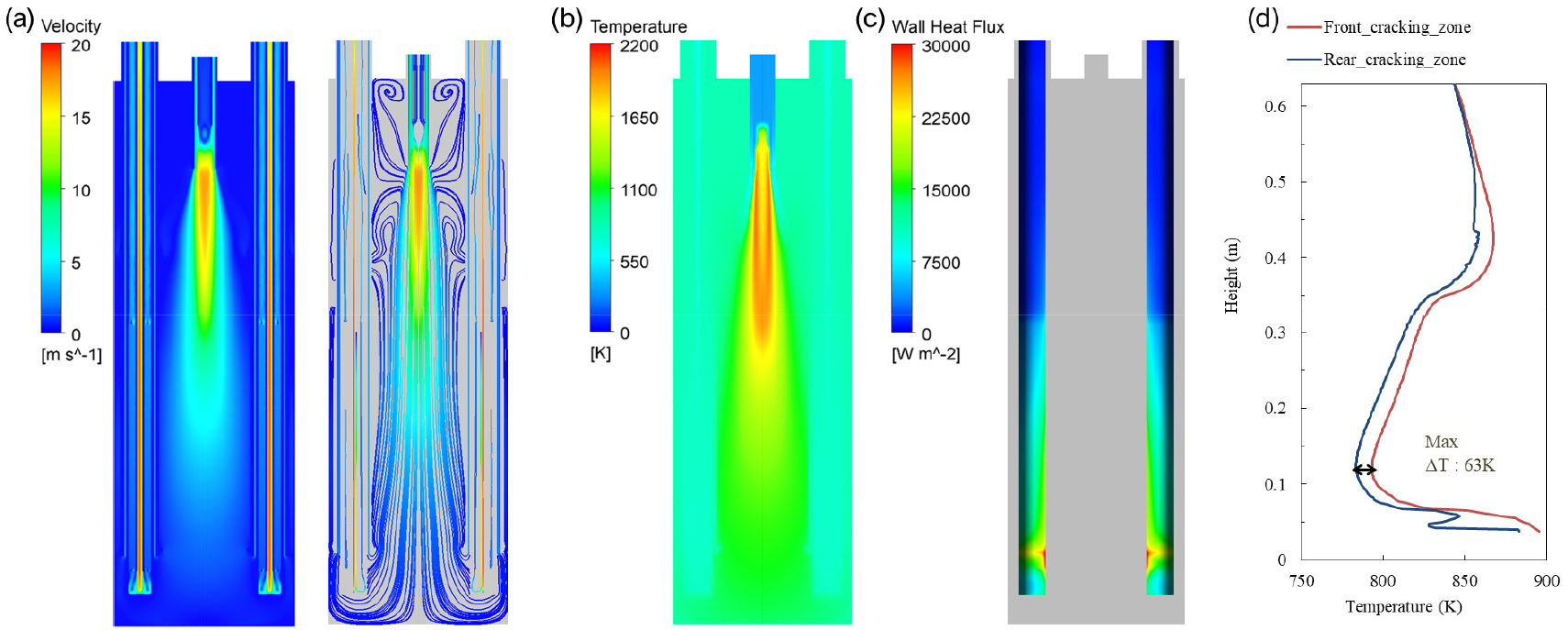
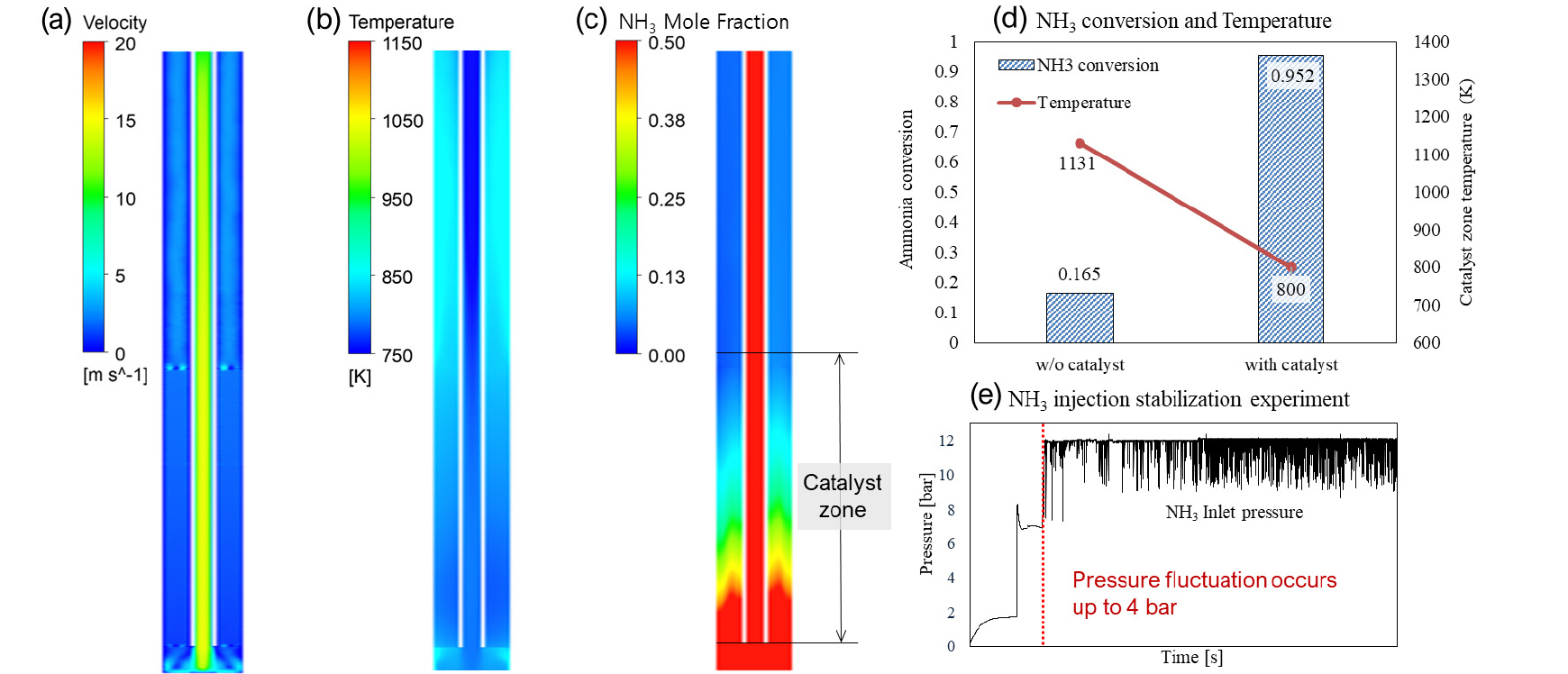
천연가스와 공기의 연소로 인해 발생 된 가스 연소 장치 내부의 유동 및 온도분포를 Fig. 2(a) 및 Fig. 2(b)에 나타내었다. 버너의 연료 주입부 끝단에서 활발한 연소 반응으로 확산화염 영역이 형성되고, 이로 인한 강한 하강기류가 생성되어 연소 가스가 장치 내부를 최대 18 m/s의 속력으로 빠른 순환 유동 구조를 형성하게 된다. 연소 가스는 암모니아 분해 튜브 벽면을 따라 지속적인 열전달 작용함과 동시에 상승하면서 출구로 빠져나가게 된다. 천연가스 연소로 인해 연소로 내부 온도는 약 1800 K 이상의 고온 영역이 형성되며, 중심에서 일어나는 연소 반응으로 인한 열전달이 암모니아 분해 튜브 중심 방향의 벽면에 집중되는 양상이 Fig. 2(c)에서 확인된다. 이에 따라 분해 튜브 열흡수율의 불균형이 나타났으며, 특히 분해 튜브 외부의 고체 벽이 존재하지 않는 하부영역에서 가장 열전달이 높게 일어났다. Fig. 2(d)는 분해 튜브와 버너 위치가 가까운 전단부와 거리가 먼 후단부의 높이에 따른 온도분포를 나타낸다. 높은 열전달로 인해 하부영역에서 온도분포가 상부영역보다 높게 나타났지만 높이 0.067 m와 0.35 m 사이에 촉매영역이 존재하기 때문에 암모니아의 강한 흡열반응으로 인해 온도가 급격하게 떨어진다. 또한, 불균일한 열전달의 결과로 분해 튜브 전/후단의 최대 온도차는 대략 63 K로 나타난다.
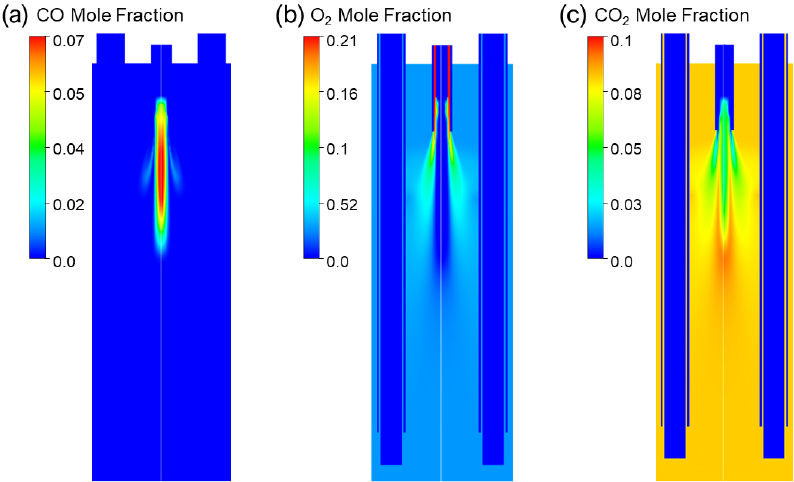
반응기 내부 CO, O2 그리고 CO2 몰분율을 각각 Fig. 3에 나타내었다. 먼저 Fig. 3(a)에서 메탄가스 연소 반응이 분해 튜브 아래 끝단에서 큰 영향을 미치지 못하는 것을 확인할 수 있다.
Fig. 3(b)에서는 투입한 산소 대부분이 연소 반응에 사용되는 것을 확인할 수 있으며, Table 4의 배출구에서 측정한 가스종들의 몰분율과 같이 산소 분율이 0.028로 대부분 연소 반응으로 인해 소진된 것을 확인할 수 있다. Fig. 3(c)는 연소로 인해 발생한 CO2의 생성을 확인할 수 있다. Table 4의 CO2의 몰분율를 보았을 때 배기가스의 8.2%정도로 배출되었다.
4.2 암모니아 분해 튜브 해석 결과
Fig. 4는 촉매를 사용하지 않고 암모니아를 열분해 해석한 결과이며, 암모니아 분해 장치의 우측 반응관 해석 결과이다. 암모니아 대부분이 수소로 분해되지 못하고 반응 영역을 빠져나갔으며, 그 결과 흡열반응이 발생하지 않아 분해 튜브 내부의 온도가 약 1100 K 이상으로 상승하였다. 내부의 높은 온도분포로 인해 암모니아 분해 튜브에 허용 한계응력 이상의 높은 열응력이 발생했으며, 장시간 장치 운전 시 분해 장치의 파손 및 폭발의 잠재적 위험이 있다.
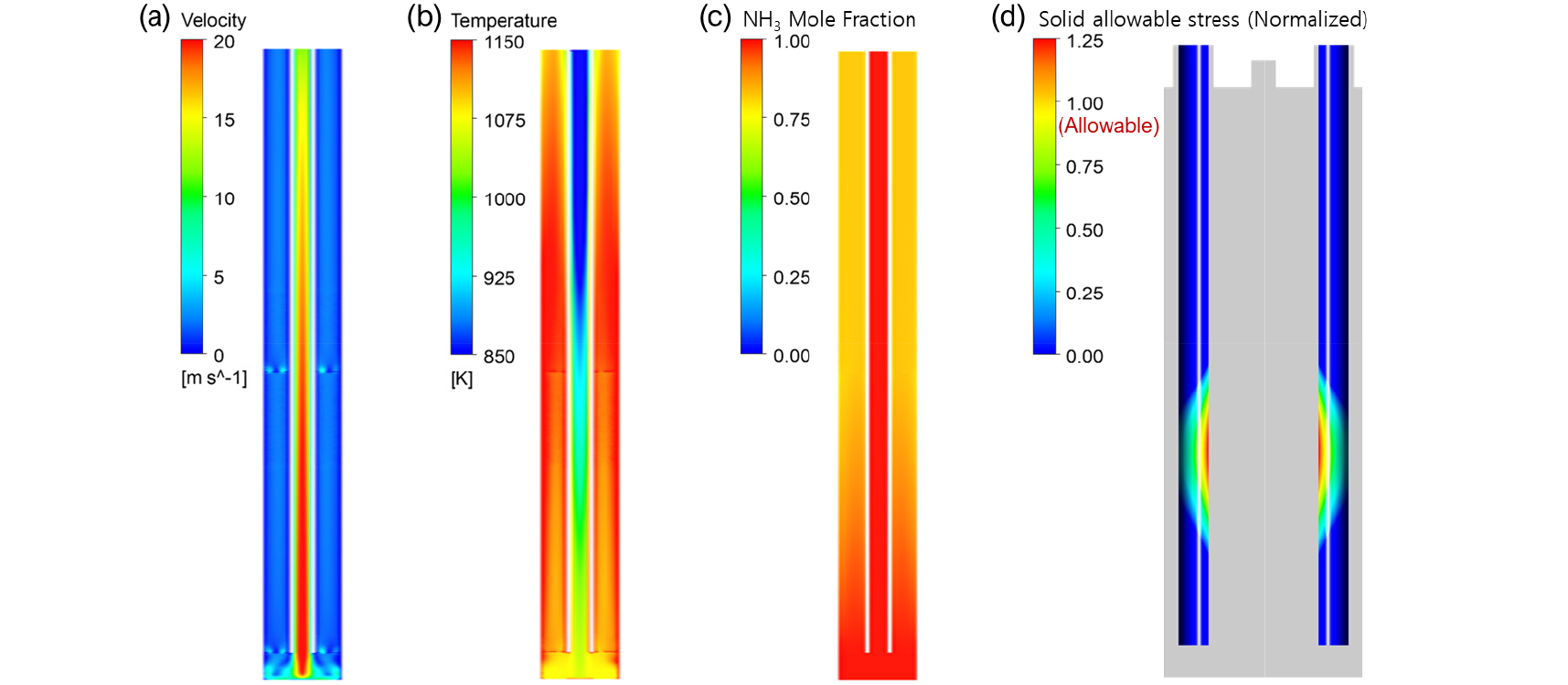
Fig. 5은 촉매를 사용하여 암모니아를 분해 튜브 해석한 결과이며, 암모니아 분해 장치의 우측 반응관 해석 결과이다. 촉매는 알루미나 구조체에 Ru 금속을 코팅한 촉매의 물성을 적용하였으며, 촉매 장입 영역에서는 균일한 온도분포를 확인할 수 있다. Fig. 5(c)에서 확인할 수 있듯 분해 튜브 내부에서 암모니아 대부분이 분해되는 것을 확인할 수 있었으며, 그 결과 암모니아의 강한 흡열 반응인 분해 반응의 결과로 분해 튜브 내부 온도분포가 안정적으로 유지되었다. 그러나, 버너와의 거리로 인해 분해 튜브 내부에서 비대칭적 온도분포가 발생함에 따라 촉매층 내부에서도 비대칭적 온도분포가 나타났다. 이러한 온도 분포는 분해 튜브 내부에서 부분적인 암모니아 열분해 화학반응을 발생시킨다. Fig. 5(e) 결과와 같이 실험적으로도 확인할 수 있듯 암모니아 분해 반응기에서 압력맥동으로 수소 생산량이 감소할 수 있고, 가스 생산의 불균형에 따라 불안정한 조업을 야기할 수 있을 뿐만 아니라 분리/흡착을 통한 정제 공정의 문제를 일으킬 수 있다.
4.3 암모니아 분해 반응기 설계 인자 도출
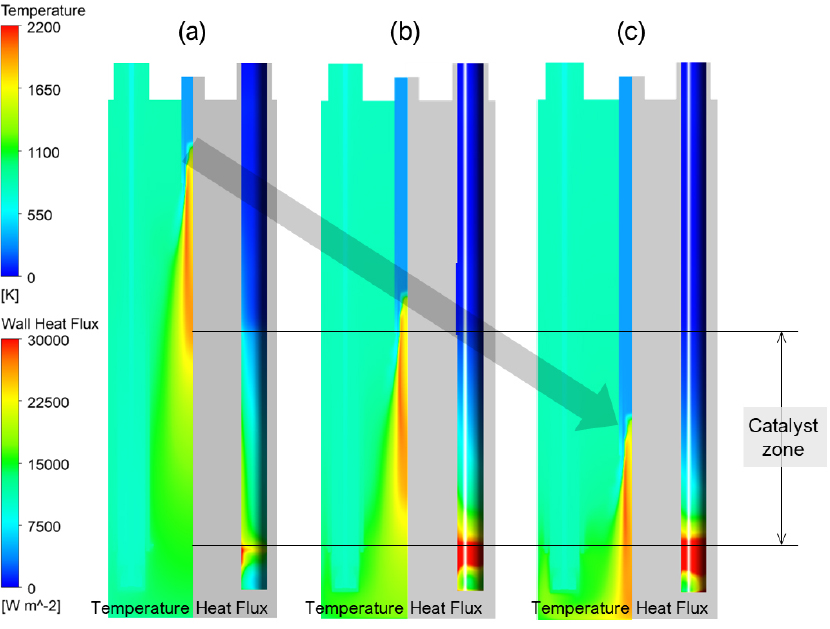
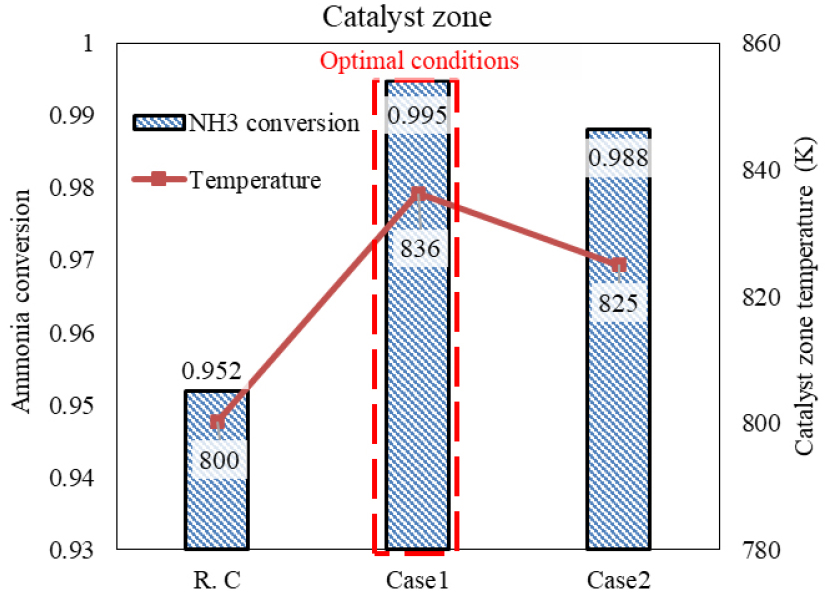
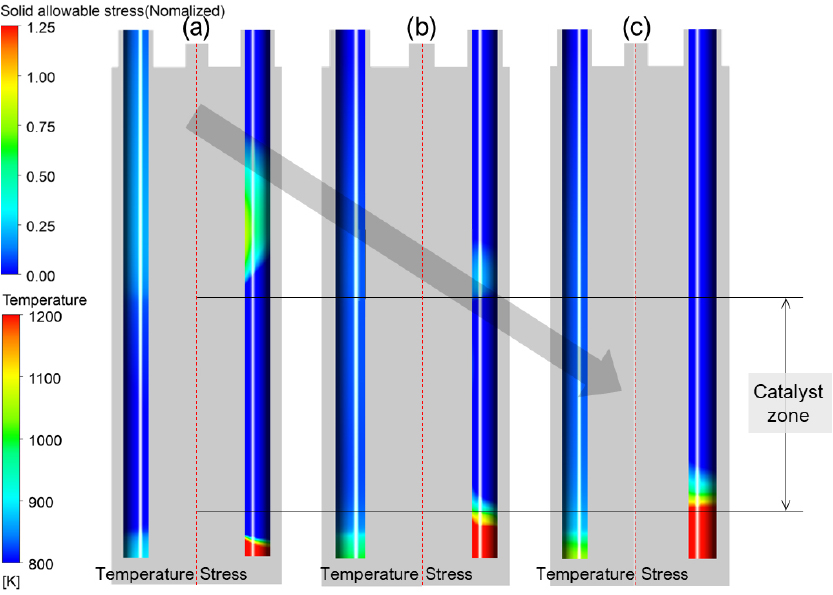
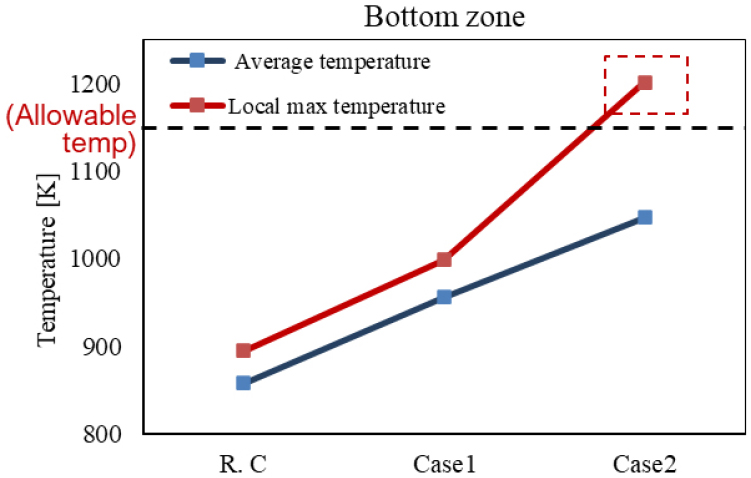
암모니아 분해 반응기의 버너 높이에 따른 온도 및 열전달 분포를 Fig. 6에 나타내었다. 이때 해석 case 별 버너의 길이는 암모니아 분해 반응기 내부에 위치될 수 있는 최대길이를 기준으로 (a) 25%, (b) 62.5% 그리고 (c) 100%의 길이로 가정하여 해석된 결과이다. 버너의 길이가짧은 Fig. 6(a)의 경우에는 충분한 열전달이 일어나지 않은 결과를 확인할 수 있으며, Fig. 7의 R.C. 결과와 같이 암모니아 분해 전환율이 95.2%임을 확인할 수 있다. 버너의 길이가 길어짐에 따라 촉매층으로 열전달량이 증가하는 것을 확인할 수 있으며, 그 결과로 Fig. 7에서 확인할 수 있듯이 촉매층 내부에서의 암모니아 분해 전환율이 최적 버너 높이 조건에서 99.5%까지 증가하게 된다. 그러나 Fig. 6(c)와 같이 버너의 길이가 과도하게 길어지면 오히려 촉매층으로의 열전달이 줄어들어 암모니아 분해 전환율이 98.8%로 최적 조건과 비교하면 감소하게 되며, 이는 Fig. 7의 Case 2 해석 결과에서도 확인할 수 있다. 따라서, 버너의 길이는 같은 양의 암모니아 연료를 사용하더라도 더 많은 암모니아를 분해 시킬 수 있는 장치 구조 인자이므로, 이는 설계 핵심 인자로 고려될 수 있다. 하지만 버너 길이가 길어짐에 따라 Fig. 9에서 확인할 수 있듯이 분해 튜브 하단영역의 온도분포가 국부적으로 1200 K 이상으로 높아지게 되고, 이는 암모니아 분해 튜브의 한계 허용응력의 허용온도인 1150 K보다 높아져 분해 튜브의 파손 위험이 생긴다.
5. 결 론
본 연구에서는 Ru 기반 촉매가 적용된 암모니아 분해 튜브의 성능을 검증하기 위해 촉매 고려 유, 무에 따른 암모니아 열분해 특성을 분석하였다. 암모니아 열분해 반응기에서 지지체를 활용한 Ru 코팅 촉매는 암모니아 열분해 효율의 증가 외에도 반응기 내부 열전달 분포 개선 등의 효과가 있는 것으로 나타났다. 선행 연구를 통해 도출한 결론은 다음과 같다.
1)촉매를 사용하지 않았을 때 분해 튜브 내부에서는 대부분의 암모니아 분해가 일어나지 않았으며 미량의 암모니아 열분해가 일어났다. 이에 따라 내부에서 열분해에 의한 흡열반응이 거의 발생하지 않아 내부 온도가 높아져 암모니아 분해 튜브의 한계 허용응력을 넘어서는 열응력이 가해지는 결과가 나타났다.
2)촉매를 고려하는 경우, Ru 담지 촉매에 의해 암모니아가 분해됨에 따라 흡열반응이 일어남을 확인하였고, 이에 따라 분해 튜브 재료의 한계 열응력이 가해지는 것을 방지되는 특성을 보였다. 이에 따라 암모니아 분해 반응의 연속성은 공정 시스템 전체에 열응력 적인 측면에서 큰 영향을 끼칠 수 있는 인자로 확인되었다.
3)암모니아 분해 튜브에서 버너의 높이는 설계인자로 고려될 수 있으며, 최적 버너 높이 달성 시 열전달 향상으로 인한 암모니아 분해 전환율을 개선할 수 있다. 그리고 장치 열응력 분포 건전성을 향상시켜 조업 안정성을 확보할 수 있었다.
기 호 설 명
: mass source term (kg)
: energy source terms
𝜏 : stress tensor
: pressure
: total heat source or sink
𝜌 : density
: resistance force
: total energy
: mass diffusion flux
𝜖 : porosity
: species mass fraction
: gas constant
: catalyst diameter
𝜇 : viscosity
: resistance force
: temperature
: length
: velocity
: catalytic reactor height
: pressure drop