1. 서 론
2. 실험장치 및 방법
2.1 배치반응기
2.2 가열 및 냉각 시스템
2.3 분해 생성물 분석
2.4 실험 절차
2.5 분석 방법
3. 실험 결과 및 토의
3.1 실험 조건
3.2 연료 전환율 및 기체 생성률
3.3 열분해 생성물
3.4 열분해 반응 모델(pyrolysis kinetic model)
4. 결 론
1. 서 론
극초음속순항비행체는 지구 대기권 내에서 마하 5 이상의 속도로 순항하는 비행체로서, 2시간 이내에 태평양을 횡단할 수 있는 극초음속 여객기와 요격이 어려운 극초음속 유도무기 등으로 다양하게 활용될 수 있으며, 따라서 항공산업과 미래 전장의 판도를 바꿀 차세대 게임 체인저(game changer)로 주목받고 있다. 극초음속 비행체의 추진기관으로 주로 사용되는 스크램제트(scramjet) 엔진은 대기 중 공기를 초음속으로 흡입한 후, 연소실 내에서도 초음속을 유지한 상태에서 연료를 연소시켜 노즐로 배출함으로써 추력을 생성한다. 이러한 스크램제트 엔진은 로켓 추진기관과 달리 대기 중의 산소를 직접 흡입하므로 별도의 산화제가 필요 없으며, 이로 인해 높은 비추력을 제공함과 동시에 구조가 단순하고 무게가 가벼울 뿐만 아니라 광범위한 속도 영역에서 운용이 가능하다[1,2].
그런데 실용적인 스크램제트 엔진을 개발하고 운용하기 위해서는 여러가지 기술적 난제를 해결해야만 한다. 특히 극초음속 비행체는 극한의 고온 조건에서 운용되는데, 예를 들면 마하 8의 속도로 비행할 경우 동체 표면의 온도는 최대 약 1000 K, 엔진 연소실의 온도는 약 2700 K에 도달한다[2]. 따라서, 현재 사용 가능한 고온 소재만으로는 비행체의 가열 문제를 완전히 해결하기 어려우며, 고속 비행으로 인한 동체 표면의 공력가열 문제와 엔진 내부의 연소 과정에서 발생하는 고온 가열 문제를 해결하기 위해서는 새로운 접근 방식이 필요하다[3]. 또한, 극초음속 비행 시 스크램제트 엔진 내부를 통과하는 공기의 체류 시간은 일반적으로 1-3 ms로 매우 짧은데, 이러한 엔진 연소실 내부의 초음속 공기 흐름 속에서도 연료가 원활하게 분무/혼합되고 안정적으로 연소되어야 한다. 따라서 고속의 공기 유동 조건에서도 효과적으로 연료를 연소시킬 수 있는 기술의 개발이 필수적이다[2].
일반적으로 극초음속 비행체의 연료로는 수소와 탄화수소 항공유가 고려되는데, 수소는 매우 빠른 화염전파속도를 가지므로 초음속 연소에 유리하며 높은 비추력을 제공하는 장점이 있다. 그러나 수소는 상온에서 기체 상태로 존재하여 밀도가 매우 낮으므로 큰 부피의 연료 탱크나, 복잡하고 무거운 극저온 저장 시스템이 요구되는 단점이 있다. 반면, 탄화수소 항공유는 수소에 비해 화염전파속도가 낮지만, 상온에서 액체 상태로 존재하여 연료 탱크의 부피를 줄일 수 있으며, 저장과 운송이 용이하다[4,5]. 또한, 이러한 탄화수소 항공유는 고온으로 가열될 경우 수소를 비롯하여 메탄, 에틸렌 등과 같은 저분자량 탄화수소로 분해되는 특성이 있는데, 이와 같이 분해된 연료가 연소실 내부로 공급되면 액체 상태의 연료보다 훨씬 빠르게 공기와 혼합되어 초음속 연소 효율을 크게 높일 수 있다. 따라서 이러한 탄화수소 항공유의 흡열분해 특성을 활용하여 극초음속 비행체의 내외부에서 발생하는 고온 문제를 해결함과 동시에, 스크램제트 연소실 내에서의 공기의 짧은 체류 시간과 복잡한 유동 조건에서도 안정적이고 효율적인 연소를 가능하게 하는 능동재생냉각시스템이 연구되고 있다[2,6].
일반적으로 탄화수소 액체연료를 이용한 재생냉각은 미세채널 내부에서의 상변화를 방지하고 열전달 특성을 향상시키기 위하여 매우 높은 압력 조건에서 이루어진다. 또한, 연료가 미세채널 내부에서 가열되면 높은 온도로 상승하고 결국 임계점을 통과하면서 밀도, 비열, 점도, 열전도도와 같은 열물리적 물성치가 급격하게 변화한다. 이로 인해 연료는 일반적인 액체 상태일 때와는 다른 유동, 열전달 및 열분해 특성을 보이게 된다[7]. 따라서, 실제로 운용 가능한 극초음속 비행체용 능동재생냉각시스템을 개발하기 위해서는 초임계 조건에서 탄화수소 항공유의 흡열분해 특성을 파악하는 것이 매우 중요하다. 이러한 탄화수소 항공유의 흡열분해 특성을 나타내는 주요 파라미터로는 흡열량, 전환율, 분해 생성물의 분포 등이 있으며[8], 최근에는 탄화수소 연료의 흡열 성능을 개선하기 위하여 다양한 첨가제와 나노촉매 등을 적용하는 연구도 활발히 수행되고 있다[9,10,11].
이러한 배경으로부터 본 연구에서는 능동재생냉각시스템의 미세채널 설계에 적용할 수 있는 global reaction PPD(Proportional Product Distribution) 모델 개발을 목표로, 초임계 조건에서 탄화수소 항공유의 열분해 특성을 분석하기 위한 배치반응기 실험장치를 구축하였다. 이러한 global reaction 모델은 실제 화학 반응을 단순화하기 때문에 열분해 반응을 정밀하게 모사하는데 한계가 있지만, 재생냉각 채널의 설계 관점에서는 수백 개에서 수천 개에 이르는 화학종과 화학 반응을 포함하는 상세 화학 반응 모델보다 단순하고 수치해석에 효율적인 장점을 가지고 있다[12,13]. 따라서 이와 같은 global reaction PPD 모델이 재생냉각 미세채널 설계를 위한 parametric study에 적용하기에 실용적인 접근법이라고 판단하였으며, 따라서 본 연구에서는 배치반응기 실험장치를 이용하여 열분해의 상세 반응 경로 분석보다는 PPD 모델 제작을 위한 최종 생성물 분석에 초점을 맞추어 실험을 진행하였다. 특히, 2장에서는 배치반응기를 이용한 열분해 실험장치를 제작하고, 연료의 열분해 특성을 평가하기 위한 연료 전환율 및 기체 생성률, 그리고 생성물 분석 방법을 제시하였다. 그리고 3장에서는 탄화수소 항공유의 주성분인 n-dodecane에 대하여 초임계 상태에서 열분해 실험을 수행하고 그 결과를 분석하였으며, 이로부터 흡열분해 반응모델의 주요 파라미터인 활성화 에너지와 pre-exponential factor를 획득하고 이를 선행연구와 비교하였다. 마지막으로 4장에서는 본 연구의 결론을 제시하였다.
2. 실험장치 및 방법
2.1 배치반응기
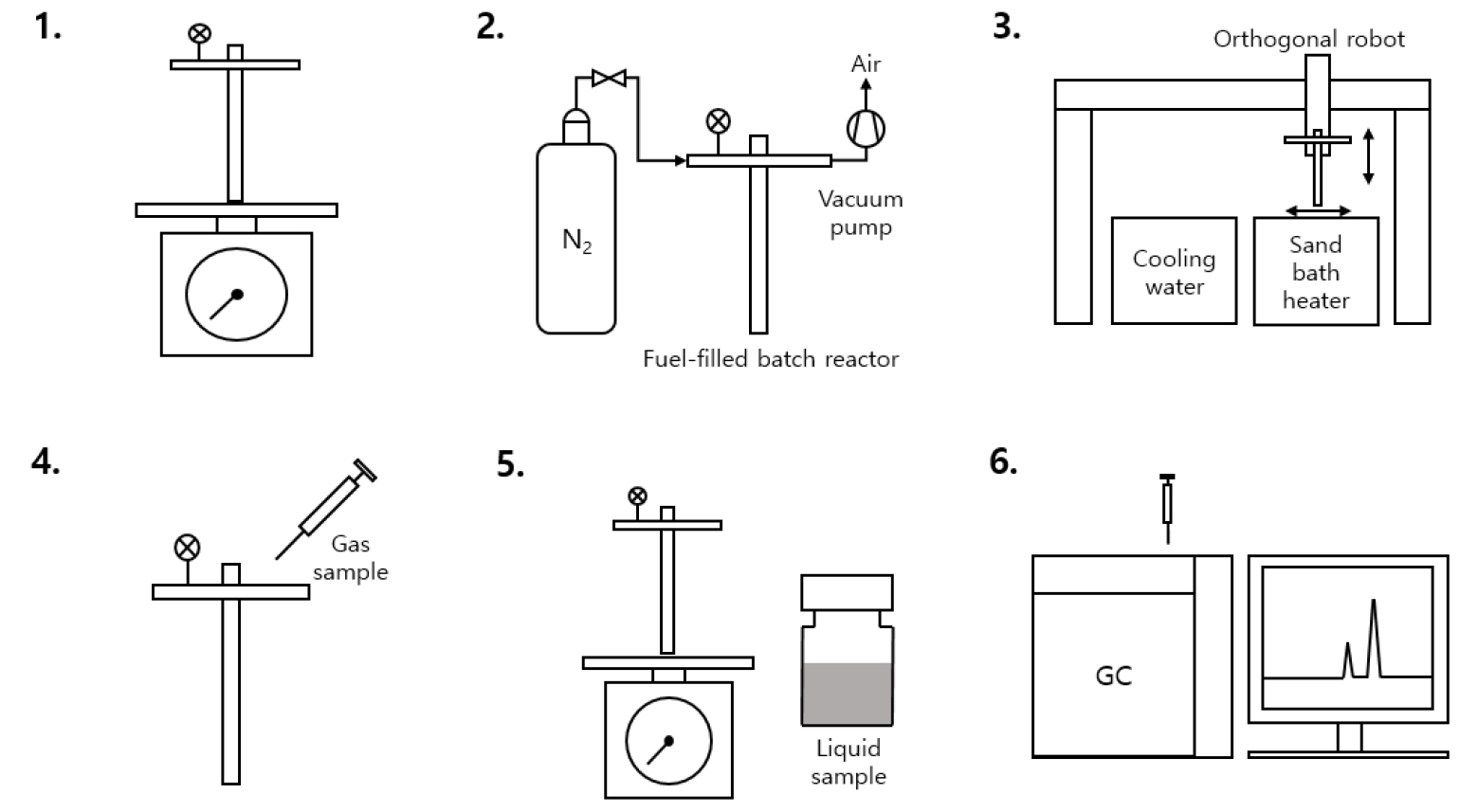
본 연구에서는 열분해 실험을 수행하기 위하여 배치반응기 실험장치를 사용하였다. 우선 배치반응기의 재질로는 인코넬(inconel)과 스테인리스 스틸(stainless steel)이 주로 고려되는데[14,15], 특히 인코넬은 내열성과 침식 저항성이 뛰어나 고온, 고압의 실험에서 많이 사용된다. 그러나 선행연구에 의하면 탄화수소 항공유의 열분해 반응은 구리, 니켈, 철, 스테인리스 스틸 순서로 영향을 많이 받는 것으로 보고되어[16], 본 연구에서는 니켈이 주성분인 인코넬 대신 촉매 분해의 영향이 상대적으로 적으면서도 내열성이 좋은 스테인리스 스틸(SUS316)을 사용하여 실험을 수행하였다[15,16]. 이러한 배치반응기는 스테인리스 스틸 튜브의 한쪽 끝을 용접하여 연료를 담을 수 있도록 제작하였으며, 반대쪽 끝은 락피팅(lok-fitting)을 통해 결합하였다. 또한, 기체의 출입을 제어하는 니들밸브와 리듀싱 티(reducing tee)로 구성하였으며, 리듀싱 티의 한쪽에는 플러그를 사용하여 기밀을 유지하였다. 이러한 배치반응기는 Fig. 1과 같이 실험장치에 장착된다.
2.2 가열 및 냉각 시스템
본 연구의 가열 및 냉각 시스템은 Fig. 1에 보이는 바와 같이 히터, 냉각수, 직교 로봇으로 구성되어 있다. 배치반응기의 가열과 냉각은 직교 로봇을 이용하여 히터와 상온의 냉각수 사이를 이동시킴으로써 이루어진다. 특히, 대부분의 이전 연구들에서는 히터의 온도 제한으로 인해 고온을 달성하기가 어려워, 연료를 저온에서 장시간 반응시켜 높은 전환율을 얻는 방식으로 열분해 실험을 수행하였다[17,18,19,20]. 그러나 본 연구에서는 산화알루미늄 모래를 압축공기로 유동화하여 가열하는 sand bath heater를 본 연구의 목적에 부합하도록 최고 700℃까지 가열할 수 있게 주문 제작하여, 고온에서 단시간 반응으로도 높은 연료 전환율을 달성할 수 있도록 하였다.
2.3 분해 생성물 분석
열분해를 통해 생성되는 물질의 분석에는 두 종류의 gas chromatography(GC) 장비를 사용하였다. 우선, 기체 생성물과 반응 전/후의 연료의 질량 분율 분석에는 불꽃 이온화 검출기(flame ionization detector, FID)가 장착된 Agilent 8860 GC를 사용하였다. 캐리어 가스로는 헬륨을 사용하였고, 상온에서 기체 상태로 존재하는 저분자량 탄화수소들은 VPHS-B capillary column(30 m × 0.53 mm × 20 μm)을 사용하여 시료 40 μl를 분할비 10:1로 주입하여 분석하였다. 오븐 온도는 60℃로 1분간 유지하고 분당 5℃로 200℃까지 올려 1분간 유지하였다. 주입기와 검출기 온도는 250℃로 설정하였으며 유량은 분당 2 ml로 설정하였다. 한편, 연료의 질량 분율 분석에는 DB-WAX capillary column(60 m × 0.32 mm × 0.50 μm)을 사용하였으며 시료는 1 ml를 분할비 400:1로 주입하였다. 오븐 온도는 70℃로 1분간 유지하고 분당 3℃로 100℃까지 올려 1분간 유지한 후 분당 7℃로 200℃까지 상승시켜 약 4분간 유지하였다. 주입기와 검출기 온도는 280℃로 설정하였고 유량은 분당 1 ml로 설정하였다.
한편, 수소의 정량분석에는 열전도도 검출기(thermal conductivity detector, TCD)가 장착된 iGC7200A GC(DS Science Inc.)를 사용하였으며, 컬럼은 molecular sieve 5A stainless steel packed column(6 ft × 1/8 inch, 80/100 mesh)을 사용하였다. 캐리어 가스는 질소를 사용하였고 유량은 분당 30 ml로 설정하였다. 시료는 분할 없이 40 μl를 주입하였으며, 오븐 온도는 60℃로 등온 상태를 유지하였고 주입기와 검출기 온도는 100℃로 설정하였다.
2.4 실험 절차
열분해 반응 실험 절차는 Fig. 2에 정리한 바와 같다. ① 빈 배치반응기의 질량을 측정한 후 연료를 주입하고 다시 질량을 측정하여 주입된 연료의 정확한 초기 질량을 계산한다. ② 진공 펌프를 사용하여 반응기 내부의 공기(특히 산소)를 모두 제거하고 고순도 질소(99.999%)를 주입하면서 실험 조건의 압력으로 가압한다. ③ 실험 조건 설정이 완료된 반응기는 직교 로봇에 장착된 후 히터로 이동하여 가열되며, 설정된 반응 시간이 경과하면 상온의 냉각수로 이동하여 즉시 반응을 종료시킨다. ④ 기체 생성물을 추출하고 반응기 내부의 기체를 배출시킨다. ⑤ 반응이 완료된 반응기의 질량을 측정하고 액체 생성물을 추출한다. ⑥ 추출된 기체 및 액체 생성물을 가스 크로마토그래피를 통해 각각 분석한다.
2.5 분석 방법
연료의 열분해 정도를 파악하기 위한 지표로는 연료 전환율과 기체 생성률이 주로 사용되는데, 배치반응기를 이용하여 열분해 실험을 수행한 선행 연구로부터 연료 전환율은 식 (1)으로, 기체 생성률은 식 (2)로 계산하였다[18].
여기에서 mo는 반응 전 액체 연료의 질량, ml은 반응 후 액체 연료의 질량을 나타낸다. wo와 wl은 각각 반응 전과 반응 후의 n-dodecane의 질량 분율을 의미한다. 액체 연료의 질량은 전자 저울로 측정하였고, n-dodecane의 질량 분율은 GC-FID 분석을 통해 얻은 피크의 면적 비율로부터 획득하였다. 한편, 실험의 재현성을 확인하기 위하여 동일한 조건에서 세 번의 실험을 수행한 결과, Table 1에 보이는 바와 같이 연료 전환율과 기체 생성률의 상대 표준 편차(relative standard deviation, RSD)는 각각 약 10%와 9%로 나타났다. 또한, GC 장비의 반복성을 확인하기 위하여 동일한 샘플을 세 번 반복 분석한 결과, TCD의 경우 Table 2에 보이는 바와 같이 수소 피크의 RSD는 약 4%로 나타났으며, FID의 경우 각 피크의 RSD는 Table 3에 나타난 바와 같으며, 평균 RSD는 약 6%로 나타났다.
Table 1.
Reproducibility of fuel conversion and gas production rate at 455°C, 40 bar, 30 min
| Parameter | Fuel conversion [%] | Gas production rate [%] |
| Test 1 | 38.30 | 4.53 |
| Test 2 | 45.87 | 4.58 |
| Test 3 | 46.30 | 5.35 |
| Average | 43.49 | 4.82 |
| STD | 4.50 | 0.46 |
| %RSD | 10.35 | 9.46 |
Table 2.
Repeatability of GC-TCD analysis results
| Parameter | Area of H2 peak |
| Test 1 | 105670 |
| Test 2 | 104833 |
| Test 3 | 112922 |
| Average | 107808 |
| STD | 4448 |
| %RSD | 4.13 |
Table 3.
Repeatability of GC-FID analysis results
3. 실험 결과 및 토의
3.1 실험 조건
본 연구에서 구축한 실험장치와 분석 방법의 검증을 위하여, 배치반응기를 이용한 초임계 n-dodecane의 열분해 실험에 관한 선행연구와 동일한 온도 조건에서 실험을 수행하였다[17]. n-dodecane의 주요 특성은 Table 4에 보이는 바와 같은데, 특히 임계 압력이 18.2 bar이고 임계온도는 384.9℃로 알려져 있으므로, 실험 조건은 연료를 초임계 상태로 유지하기 위하여 반응 압력 40 bar, 반응 온도 420℃ 이상으로 설정하였다. 이러한 실험 조건은 Table 5에 정리한 바와 같으며, 특히 선행연구에서 설정된 온도 조건에서 연료 전환율과 화학 반응 상수를 비교하기 위하여 연료 2 ml를 420℃, 440℃, 455℃ 조건에서 각각 10분, 20분, 30분 동안 반응시켰다.
실험 도중 배치반응기 내부의 온도와 압력은 열전대와 압력 센서를 장착한 예비 실험을 통해 확인하였다. 반응기 내부의 압력은 반응이 진행되면서 기상 물질이 생성됨에 따라 최대 60-70 MPa까지 상승하였는데, 배치반응기 실험장치의 특성상 압력을 일정하게 유지하려면 실험 중 기체 생성물을 배출해야 하며, 이렇게 되면 생성물의 무게, 연료 전환율 및 기체 생성률의 정확한 계측이 불가능해진다. 이는 정적(constant volume) 반응기를 이용하는 실험의 한계로서, 배치반응기 실험장치를 이용한 이전의 연구들에서도 동일한 상황이다[18,21]. 이러한 이유로 본 연구에서는 실험 결과가 압력에 영향을 일부 받을 것으로 예상됨에도 불구하고 그대로 실험을 진행하였다. 한편, 연료 온도는 2분 내 히터 설정 온도에 10℃ 이내로 도달한 후 전체 반응 시간 동안 평균적으로 5℃ 이내의 온도 차이를 유지하였다. 본 연구에서는 이러한 온도 차이를 허용 가능한 범위로 간주하여 연료 온도를 히터 설정 온도와 동일하게 취급하였다. 이러한 배치반응기 내부의 온도와 압력 특성을 확인한 후 무게 측정의 용이성과 열분해 반응에 미치는 영향을 최소화하기 위해 열전대와 압력 센서를 제거하고 본 실험을 진행하였다.
Table 4.
Basic characteristics of n-dodecane
| Parameter | Value |
| Molecular weight | 170.3 kg/kmol |
| Critical pressure | 18.2 bar |
| Critical temperature | 384.9℃ |
Table 5.
Experimental conditions
| Parameter | Value |
| Temperature | 420-455℃ |
| Initial pressure | 40 bar |
| Reaction time | 10-30 min |
| Fuel volume | 2 ml |
3.2 연료 전환율 및 기체 생성률
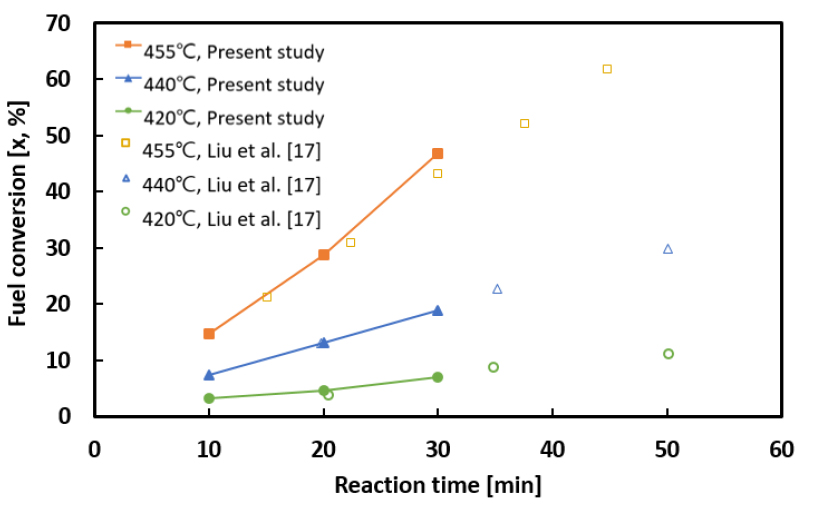
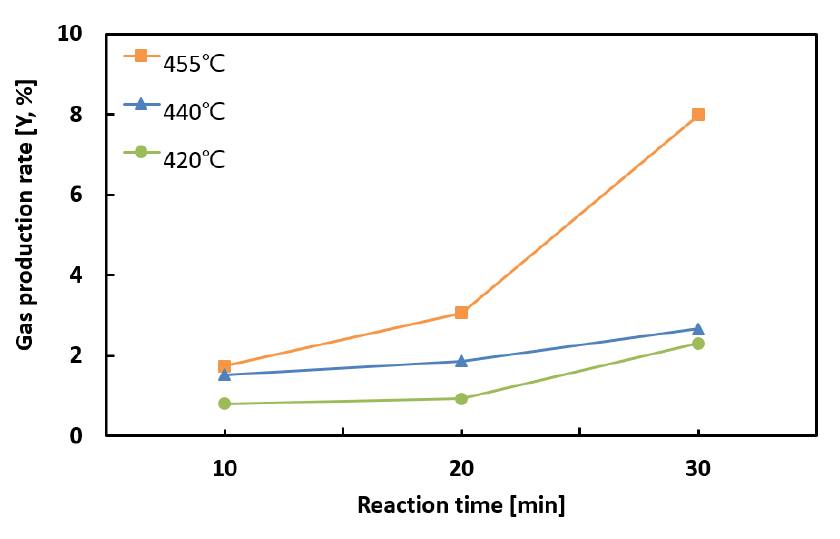
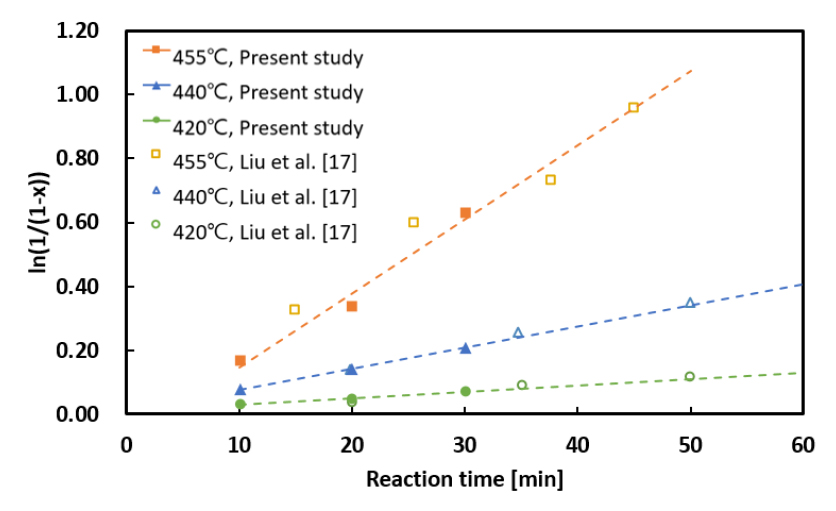
열분해 실험으로부터 획득된 연료 전환율과 기체 생성률을 Fig. 3과 Fig. 4에 각각 도시하였다. 그림에 보이는 바와 같이 본 연구의 연료 전환율은 약 3%에서 최대 47%까지 나타났으며, 기체 생성률은 약 0.7%에서 최대 8%까지 측정되었다. 또한 연료 전환율과 기체 생성률 모두 반응 온도와 반응 시간이 증가함에 따라 증가하는 경향을 나타냈으며, 특히 Fig. 3에 보이는 바와 같이 본 연구에서 측정된 연료 전환율이 Liu 등[17]의 선행연구 결과와 매우 유사함을 확인함으로써 본 연구의 실험장치와 분석 방법의 신뢰성을 1차적으로 검증하였다.
3.3 열분해 생성물
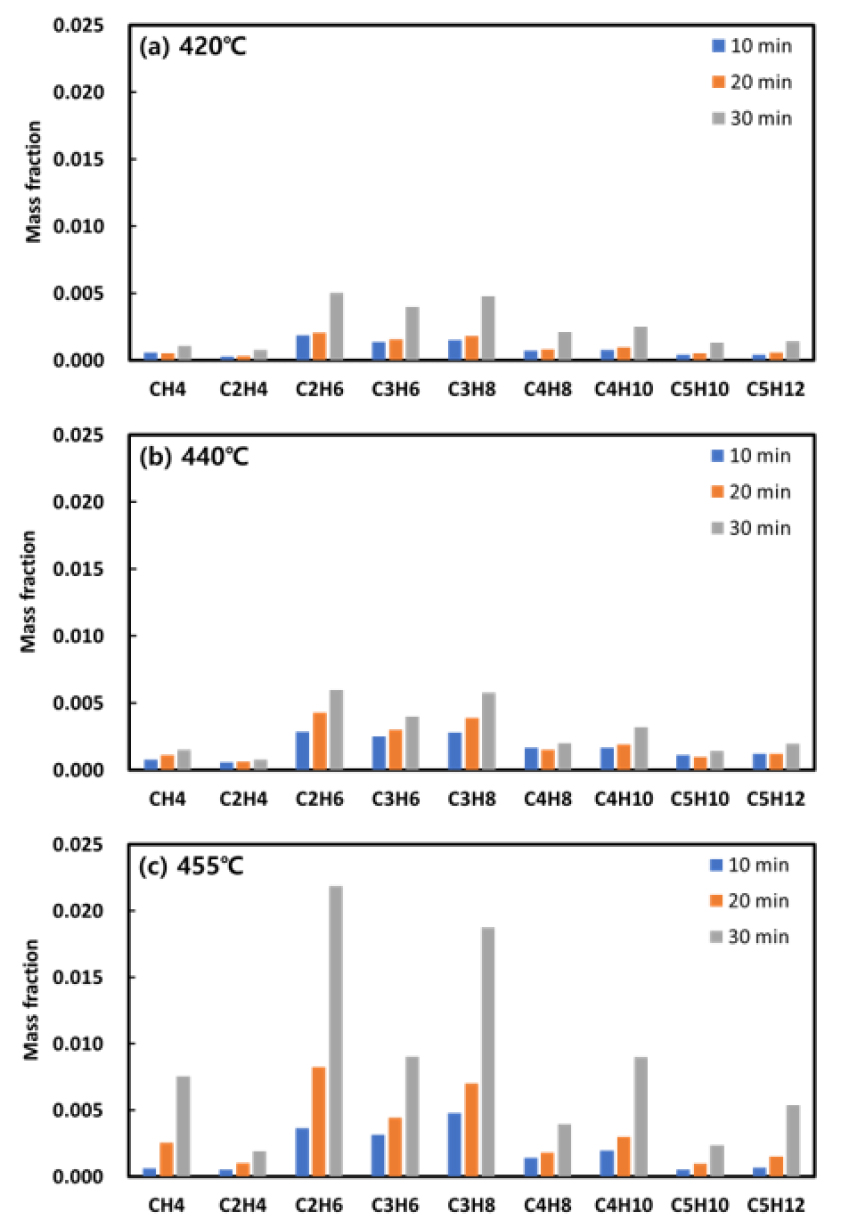
열분해 실험 결과 생성된 기체 생성물을 분석하여 Fig. 5와 Fig. 6에 도시하였다. 열분해 생성물의 peak와 표준 가스의 peak를 비교하여 정성분석을 수행한 결과, 기체 생성물의 구성 성분은 H2, CH4, C2H4, C2H6, C3H6, C3H8, C4H8, C4H10, C5H10, C5H12로 확인되었다. 한편, 본 연구에서 사용한 모세관 컬럼(VPHS-B)은 제조사가 제공한 retention index 데이터에 의하면 서로 다른 물질임에도 retention time이 같거나 유사한 경우가 존재하여, 모든 이성질체를 분리하여 정확하게 식별하는 데 한계가 있었다. 따라서 본 실험 결과에서는 탄소 개수가 4개 이상인 화합물의 경우 C4H8, C4H10, C5H10, C5H12들과 같이 각각 하나의 피크로 나타났으며, 이는 여러 종류의 이성질체들이 겹쳐있는 결과인지, 한가지 물질만 나타난 것인지 명확히 구분할 수 없는 상황이다. 그럼에도 불구하고 이러한 결과는 본 연구의 목적인 대표적인 생성물들을 기반으로 한 global reaction PPD 모델 개발에는 문제가 되지 않는 것으로 판단하여 모든 이성질체를 구분하지 않고 하나의 대표 물질로 나타내었다. 각 반응 온도와 반응 시간에서의 분포를 Fig. 5에 나타내었으며 대부분의 경우 C2H6가 가장 많이 생성된 반면 C2H4는 가장 적게 생성되었다. 또한 반응 온도와 반응 시간이 증가할수록 기체 생성물의 질량 분율이 증가하는 것을 확인할 수 있다.
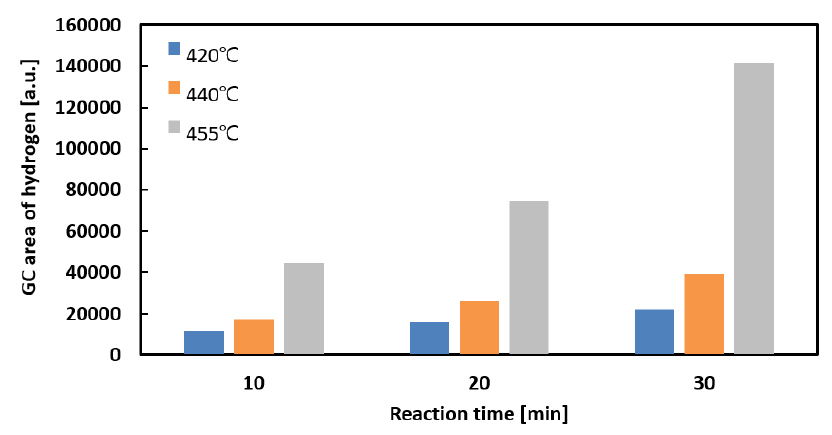
다음으로 수소 생성량은 Fig. 6에 정리하였는데, 이는 GC-TCD의 분석 결과로부터 획득된 수소 peak의 면적을 통해 상대적인 생성량으로 비교하였다. 본 연구에서는 수소 표준 가스를 이용한 정량분석을 통해 수소 생성량을 질량 분율로 분석한 결과를 도출하였으나, 그 결과가 선행연구에 제시된 수치에 비하여 매우 낮은 것으로 확인되었다. 현재 이를 개선하기 위하여 보다 정밀한 수소의 정량 분석법을 연구 중이며, 따라서 본 논문에서는 수소의 절대량 대신 반응기 온도 유지 시간에 따른 상대적 경향성을 중심으로 논의하였다. 분석 결과 그림에 보이는 바와 같이 반응 온도와 반응 시간이 증가할수록 수소의 생성량이 증가하는 경향을 보였다.
3.4 열분해 반응 모델(pyrolysis kinetic model)
실제 열분해 반응은 무수히 많은 개별 화학 반응들이 복합적으로 발생하므로 매우 복잡한 과정이다. 그러나 많은 선행연구들에서 열분해 반응을 아래와 같이 일차 반응(1st-order reaction)으로 단순화하여 식 (3)과 같이 나타내었다[17,20].
위 식에서 C는 반응물의 농도를 나타내며 t는 반응 시간을, k는 1차 반응속도상수를 나타낸다. 이러한 1차 반응은 식 (4)와 같이 연료 전환율(x)의 함수로 나타낼 수 있으며, 이를 통해 1차 반응속도상수를 계산할 수 있다.
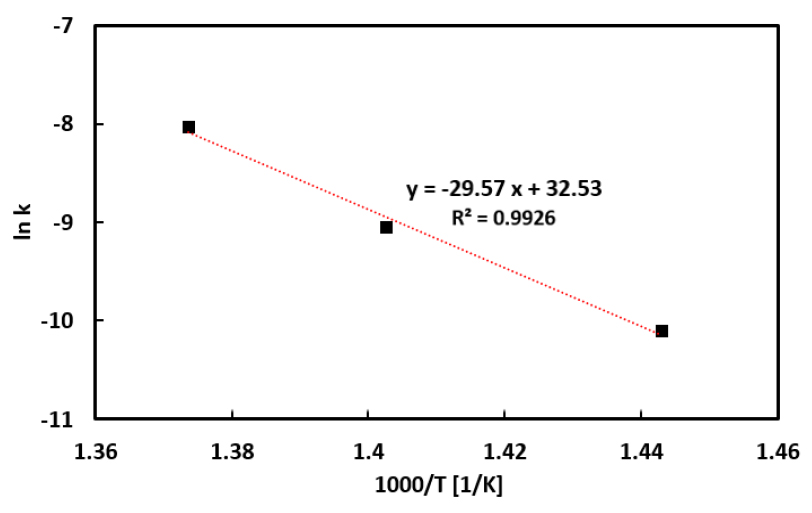
식 (4)를 바탕으로, 반응속도상수는 각 반응 온도에서 시간에 따른 ln[1/(1-x)] 그래프를 그려 선형회귀 기법으로 계산된 기울기를 통해 구할 수 있다. Fig. 7에 본 연구의 결과와 선행연구의 결과를 함께 나타내었으며 연료 전환율과 마찬가지로 Liu 등의 선행연구[17]와 유사한 경향을 보이는 것을 확인하였다. Table 6에는 Fig. 7의 데이터를 사용하여 계산된 1차 반응속도상수를 나타내었으며, 이를 사용하여 식 (5)의 아레니우스 법칙을 통해 활성화 에너지(Ea)와 pre-exponential factor(A)를 계산하였다. 특히, 식 (6)과 같이 변형된 아레니우스 관계식으로부터 활성화 에너지(Ea)는 Fig. 8의 기울기를 통해 구하고 pre-exponential factor(A)는 y 절편을 이용하여 계산하였다.
분석 결과 본 연구로부터 획득된 활성화 에너지(Ea)는 245.9 kJ/mol로, 그리고 pre-exponential factor(A)는 1.35×10 s-1으로 나타났다. Table 7에는 여러 선행연구들과 본 연구의 실험으로 도출된 결과를 비교하여 정리하였는데, 이를 통하여 본 연구 결과가 이전 연구들과 매우 유사함을 알 수 있으며, 특히 본 연구와 Liu 등[17]의 선행연구 결과와의 활성화 에너지 상대 표준 편차는 약 4.17%로 확인되었다.
Table 6.
1st-order rate constant of n-dodecane at various temperatures
|
T [℃] |
Reaction time [min] |
Rate constant [1/s] |
| 420 | 10-30 | 4.11×10-5 |
| 440 | 1.18×10-4 | |
| 455 | 3.25×10-4 |
Table 7.
Kinetic parameters for pyrolysis of n-dodecane
| A [1/s] | Ea [kJ/mol] |
P [MPa] | References |
| 2.45×1014 | 225.8 | 3 | Zhang et al [22] |
| 5.40×1013 | 242.7 | 0.69-1 | Yoon et al [19] |
| 5.62×1014 | 256.6 | 3.1-4.3 | Liu et al [17] |
| 1.35×1014 | 245.9 | 4 | Present study |
4. 결 론
본 연구에서는 배치반응기를 이용한 탄화수소 항공유의 열분해 실험장치를 제작하고, 연료의 흡열분해 특성을 평가하는 파라미터로서 연료 전환율 및 기체 생성률, 그리고 분해 생성물 분석 방법을 정립하였다. 또한 이를 이용하여 대표적인 탄화수소 항공유의 주성분인 n-dodecane에 대하여 초임계 상태에서 열분해 반응 실험을 수행하고 다양한 반응 온도 및 시간 조건에서의 흡열분해 특성을 파악함과 동시에, 그 결과를 토대로 열분해 반응을 1차 반응으로 단순화한 경우에 대하여 활성화 에너지와 pre-exponential factor를 계산하였다. 그 결과 이러한 반응 파라미터들이 선행연구들과 매우 유사함을 확인하였으며, 이를 통하여 본 연구에서 구축한 열분해 실험장치의 신뢰성을 검증하였다.
앞으로 본 연구 그룹에서는 이와 같이 구축된 배치반응기 실험장치를 활용하여 다양한 초임계 탄화수소 항공유에 대한 열분해 실험을 수행하고, 그 결과를 토대로 재생냉각 채널 설계에 활용할 수 있는 탄화수소 연료의 global reaction PPD 모델을 개발하는 연구를 수행할 계획이다. 또한, 추후 개발 예정인 나노촉매가 첨가된 흡열연료와 다양한 기능성 첨가물이 포함된 탄화수소 연료에 대한 열분해 특성 실험을 수행하여 이들의 열분해 성능을 평가함으로써 극초음속 비행체에 최적화된 연료를 개발하는 데에 기여할 수 있을 것으로 기대된다.