1. 서 론
2. 실험장치 및 방법
2.1. 저속열분해 실험
2.2. 실험조건
2.3. 분석방법
3. 결과 및 고찰
3.1. 바이오매스 연료 특성
3.2. 실험 조건별 반응기 온도 분포
3.3. 저속열분해 생성물 수율
3.4. 바이오차 특성 분석
3.5. 바이오오일 특성 분석
3.6. 비응축성 가스 특성 분석
결론
1. 서 론
파리 기후 협약에 따라 기후 변화의 원인이 되는 온실가스 배출을 감축하기 위한 다각적인 노력이 전 세계적으로 지속되고 있다. 우리나라 또한 발전과 산업 분야에서 최근 2030년까지 총 1억2천만 톤의 CO2를 감축하고자 하는 목표 달성을 위해 다양한 정책을 펼치고 있다. 세계적으로 풍력, 태양광 발전 기술의 발달, 발전원가의 하락 그리고 ESS 연계를 통한 이용률 향상 등에 따라 신재생발전을 통한 온실가스 저감은 이전에 비해 비관적이지는 않다. 하지만 IPCC가 제안한 1.5℃ 목표를 달성하기 위해서는 온실가스 감축량을 획기적으로 증가시키거나 발전 이외의 부문에서 달성하지 못하는 감축량을 보완할 수 있는 수단이 필요하다.
Lehmann[1]은 바이오매스를 활용하여 대기 중의 탄소를 토양에 저장하는 탄소 네거티브(Carbon Negative)라는 새로운 메커니즘을 제안하였다. 대기 중의 탄소를 함유한 바이오매스를 열분해 결과물 중 하나인 바이오차(Biochar) 형태로 토양에 저장하는 개념이다. 바이오매스는 열분해 과정에서 셀룰로오스, 헤미셀룰로오스와 리그닌에 포함된 고분자 화합물 간의 화학결합을 끊어 일부가 휘발분의 형태로 배출되고, 남은 성분은 재배열되어 바이오차를 형성한다. 배출된 휘발분은 액체 형태의 바이오오일과 기체 형태의 비응축성 가스로 구분된다. 생성물의 비율과 특성은 열분해 온도와 시간에 따라 크게 달라진다.
바이오차는 휘발 성분이 분리되어, 탄소 골격 위주만 남기 때문에 표면적이 매우 큰 다공성의 물질이며[2], [3], 일반적으로 염기성을 띄고[4] 표면에 피라논(pyranone), 락톤(lactone), 페놀(phenolic), 카르복실(carboxylic), 다이옥신(dioxin), 아민(amine), 니트로(nitro) 기 등을 함유하고 있다[5]. 바이오차의 물리·화학·생물학적 특성에 의해 토양 개량제, 배터리 등의 음극제, 수질 오염 처리 흡착제, 전자파 차폐용 소재 등 50여 가지 이상의 분야에 활용성이 보고된 바 있다[6].이에 따라 바이오매스의 저속열분해 및 바이오차 특성에 대한 다양한 연구가 수행 중에 있다.
바이오매스 열분해 공정과 관련하여, Chen 등[7]은 실험실 규모의 배치 열분해 장치를 활용하여 white ash(물푸레), switchgrass, 옥수수대의 열분해에서 생산된 바이오차, 합성가스 및 바이오오일의 특성을 분석한 바 있다. Park 등[8]은 볏짚을 원료로 실험실 규모의 배치 열분해 장치를 통해 300~700℃ 온도 조건에 대해 열분해 수율, 바이오차의 화학 조성 그리고 물리적 특성 등을 분석하였다. Lee 등[9], [10]은 500℃ 조건에서 사탕수수 찌꺼기(sugarcane bagasse), 야자 토탄(cocopeat), 볏짚, PKS(Palm Kernell Shell), 거대억새 등 다양한 바이오매스 원료의 바이오차 특성을 분석하였다.
전술한 다양한 바이오매스 열분해 연구는 대부분 실험실 규모의 배치 반응기를 적용하였고, 열분해에 필요한 에너지는 반응기 벽을 통해 간접적으로 공급되었다. 그러나 바이오매스 저속열분해 기술의 상용화를 위해서는 연속 공정 및 직접 열교환에 대한 연구 등이 필요하다. Kim 등[11]은 고온의 발전소 배가스(CO2, 12.9 vol.%; H2O, 13.5%; O2, 0.9%)를 추출하여 열분해 반응기에 직접 주입하는 방식으로 바이오차를 대량 생산하는 공정을 제안하고 해석적 연구를 수행하였다.
본 논문에서는 파일럿 규모의 열분해 반응기에 대해 400~700℃ 온도 범위의 간접 가열 열분해 공정과 및 질소 기반의 캐리어 가스를 이용한 직접 가열 열분해 공정으로 구분하였다. 각기 다른조건에 대한 우드펠릿의 열분해 특성을 분석하여 상용급 시스템 제작에 필요한 파라미터들을 얻고자 하였다.
2. 실험장치 및 방법
2.1. 저속열분해 실험
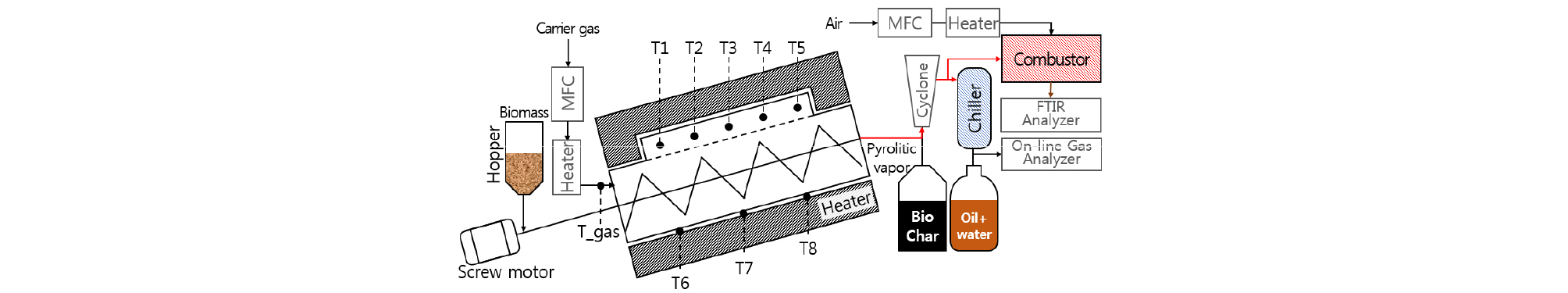
바이오차 생산을 위한 연속식 스크류 열분해 시스템의 개념도는 Fig. 1과 같다. 반응 시스템은 바이오매스 공급부, 가스 혼합 및 예열부, 열분해부, 바이오차 포집부, 바이오오일 포집부, 열분해 증기 연소부 등으로 구성된다. 바이오매스는 상단 호퍼를 통해 일정 투입량으로 미리 승온된 반응기 내부로 공급된다.
열분해 반응기는 내경 108 mm, 길이 1,000 mm의 규격으로 SUS 316L 재질로 구성되었으며, 반응기는 3단 전기히터와 단열재가 감싸고 있다.
반응기 벽면 온도는 반응기 하단에 위치한 3개의 K-type 열전대로 제어되며, 반응기 내부의 온도는 스크류 상단에 설치된 5개의 K-type 열전대로 실시간 측정된다.
반응기 내부로 공급되는 이송 가스 유량과 온도는 MFC (Mass Flow Controller)와 Gas pre-heater를 통해 제어되며, 예열부에서 승온된 후 반응기로 공급된다.
투입된 바이오매스는 반응기 내에서 13분의 체류시간을 거쳐 전기히터와 고온 이송 가스를 열원으로 하여 열분해 되며, 생성된 바이오차는 반응기 후단의 용기에 포집되어 상온에서 냉각된다. 생성된 열분해 증기는 싸이클론을 통해 미세입자가 제거된 후 -10℃로 운전되는 냉각부에서 타르 및 수분이 응축되어 바이오오일의 형태로 포집된다. 후단으로 배출되는 비응축 가스(CO2, CO, H2 , CH4 등)는 온라인 성분 분석기를 이용하여 실시간으로 분석하였다.
2.2. 실험조건
연속식 바이오매스 열분해 실험 조건은 Table 1에 나타난 바와 같다. 실험에 사용된 바이오매스는 우드펠릿이며, 1.53 kg/hr의 투입량으로 원주형의 입자형태를 유지하면서 반응기에 공급하였다. 또한 이송 가스는 반응기 투입 전 가스 예열기를 통해 700℃로 승온하여 반응기로 투입하였다.
Table 1. Experimental conditions
| Heat transfer | Reactor temp. (℃) | Carrier gas composition | Carrier gas flow rate |
| Indirect | 400~700℃ | N2 100% | 10 LPM |
| Direct | 400~600℃ | N2 100% | 120 LPM |
| 500℃ | N2 98%, O2 2% | ||
| N2 96%, O2 4% |
실험조건은 열전달 방식(간접 열교환, 직접 열교환)에 따라 구분하였으며, 이때 직접 열교환을 모사하기 위해 120 LPM의 고온으로 승온된 가스를 투입하였다. 반면 간접 열교환 실험에서는 발생되는 열분해 증기의 배출과 공기 누설에 의한 반응기 내부 연소방지를 위해 10 LPM 의 이송 가스(질소)를 주입하였다.
또한, 열분해 온도에 의한 바이오차 특성의 영향을 파악하기 위해 반응기 내부 온도를 400~700℃로 설정하였고, 투입가스 내 산소 농도에 따른 영향을 평가하기 위해 이송 가스에 산소를 2%, 4% 포함한 조건에 대해서도 실험을 수행하였다.
2.3. 분석방법
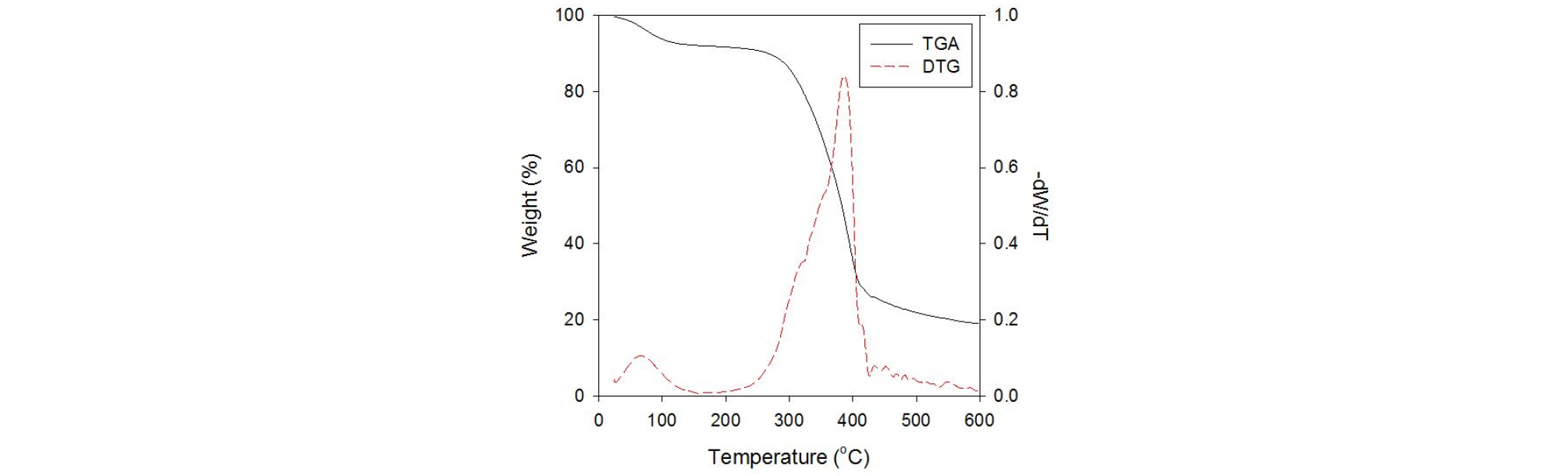
열분해 실험에 앞서 대상 바이오매스의 온도에 따른 열분해 특성을 파악하기 위해 TGA (Thermo gravimetric Analysis) 분석을 진행하였다. TGA 분석은 TG analyzer (Scinco, TGA N-1000) 분석기를 사용하였으며, 약 10 mg 내외의 파우더 형태의 바이오매스 샘플을 백금 도가니에 넣고 최고온도 600℃ 까지 20℃/min 으로 승온시키며 질량 변화를 측정하였다.
바이오매스와 바이오차 샘플의 공업분석은 ASTM 표준(수분: ASTM E871-82, 휘발분: ASTM E872-82, 회분: ASTM D1102-84) 공업분석 방법을 적용하여 분석하였다. 또한, 원소분석(C, H, O, N)은 EA 분석기(CE Instruments, EA 1108)을 이용해 C, H, N을 분석하고 O는 공제법으로 계산하였다.
바이오차의 토양 활용 시 토양질 개선에 중요한 역할을 하는 표면 특성을 분석하기 위해 바이오차 샘플의 미세 비표면적을 표면 분석기(Micromeritics, Tristar 3020)를 이용해 N2-BET법으로 분석하였다. 이밖에 각 샘플의 고위발열량은 원소분석 결과를 통해 아래와 같은 Channiwala [12] 식으로 계산하였다.
HHV=0.3491C+1.1783H+0.1005S−0.1034O−0.015N−0.211A(MJ/kg)
3. 결과 및 고찰
3.1. 바이오매스 연료 특성
저속열분해 실험에 사용된 우드펠릿의 기초 연료 특성(공업분석, 원소분석, 고위발열량)을 Table 2에 나타냈다. 우드펠릿의 원료가 목질계 바이오매스(폐목재, 톱밥 등)이기 때문에 휘발분 함량이 고정탄소 함량에 비해 매우 높고 회분함량이 낮은 일반적인 lignocellulosic 바이오매스의 특성을 나타냈다.
Table 2. Properties of biomass sample
| Biomass sample | Wood pellet | |
| Proximate analysis (wt.%wet) | Moisture | 3.25 |
| Volatile matter | 82.54 | |
| Fixed carbona | 13.68 | |
| Ash | 0.53 | |
| Ultimate analysis (wt.%daf) | C | 48.84 |
| H | 6.11 | |
| Oa | 44.84 | |
| N | 0.21 | |
| HHV | (MJ/kg) | 18.99 |
Fig. 2는 우드펠릿의 TGA 분석 결과를 나타낸 것이다. 약 100℃ 내외에서 수분이 증발하였고, 약 200℃ 이후 열분해가 시작되었다. 열분해 초기에는 헤미셀룰로오스의 분해가 약 20~400℃ 온도 범위에서 일어나며, 약 300℃에서 무게 감소가 최대가 된다. 이어 300~430℃ 사이에서 셀룰로오스의 분해가 일어나며 약 390℃에서 분해 속도가 최대가 되는 것으로 나타났다. 이후 넓은 범위의 온도에서는 잔류 리그닌의 분해가 서서히 일어나는 것을 확인할 수 있었다.
3.2. 실험 조건별 반응기 온도 분포
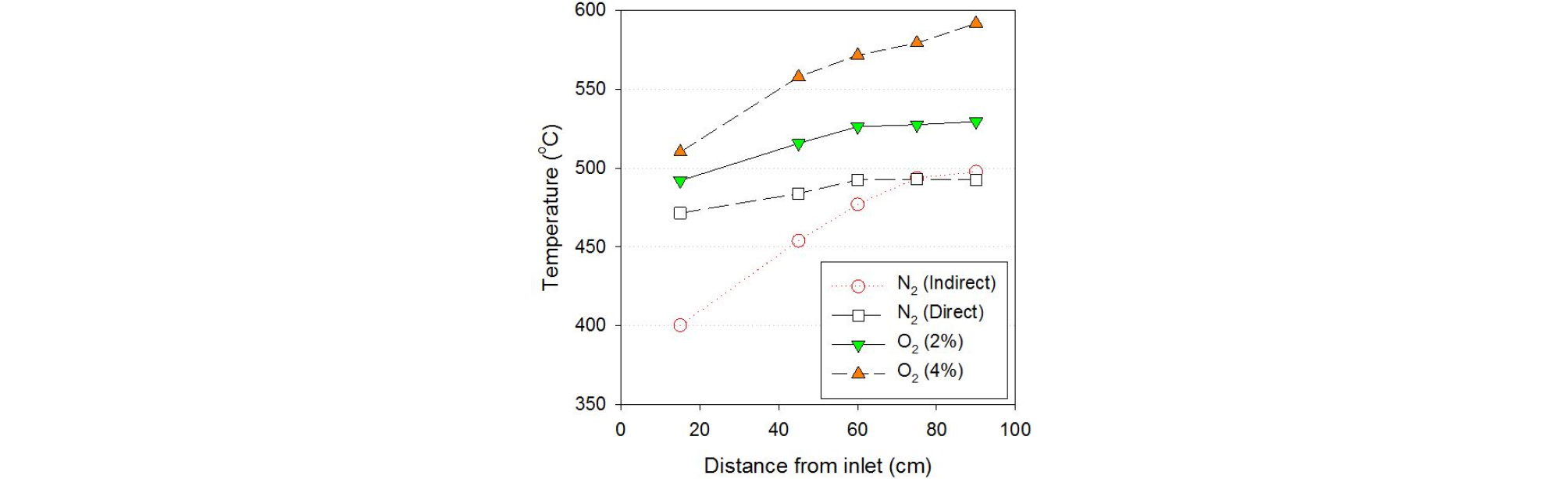
Fig. 3은 설정 온도 500℃에 해당하는 실험 조건에서 정상상태에 도달한 반응기 내부 온도를 길이 방향으로 나타낸 그림이다. 실험 방법은 전술한 바와 같이 예열된 히터로부터 공급되는 고온의 이송 가스와 외부 전기 히터를 열원으로 사용하였다. 간접열교환 방식의 경우 상온으로 투입된 바이오매스에 의한 열교환으로 인해 반응기 투입부의 온도는 상대적으로 낮으며, 반응기를 따라 진행하며 점차적으로 온도가 상승해 반응기 후단에서 설정 온도에 가깝게 유지되는 것을 확인할 수 있다. 반면, 직접열교환 방식의 경우 간접열교환에 비해 투입부 온도가 설정 온도에 더 가깝게 높으며, 보다 빨리 설정온도에 도달하여 후단까지 유지하는 것을 확인할 수 있다. 이를 통해 알 수 있는 점은 두 방식 모두 최종 온도는 유사하지만 승온 과정이 다르다는 것이며, 직접열교환의 경우 바이오매스 투입 이후 초반부의 승온이 상대적으로 매우 빠름을 알 수 있다.
반면, 이송가스에 산소가 포함될 경우 기준 조건에 비해 반응기 내부의 온도가 전체적으로 상승(2% 조건 529℃, 4% 조건 592℃)하는 것을 확인할 수 있는데, 이는 이송가스에 포함된 산소와 열분해 증기의 부분적 산화 반응으로 인한 것이다[13]. 다만, 이송가스 내 포함된 산소의 농도가 2~4%로 낮기 때문에 활발한 연소가 아닌 제한적인 승온만 일어난다. 따라서, 이를 활용하여 배가스의 유량을 줄이고 부분 산화를 유도하여 공정에 필요한 외부 공급 열량을 줄일 수 있을 것으로 판단된다.
3.3. 저속열분해 생성물 수율
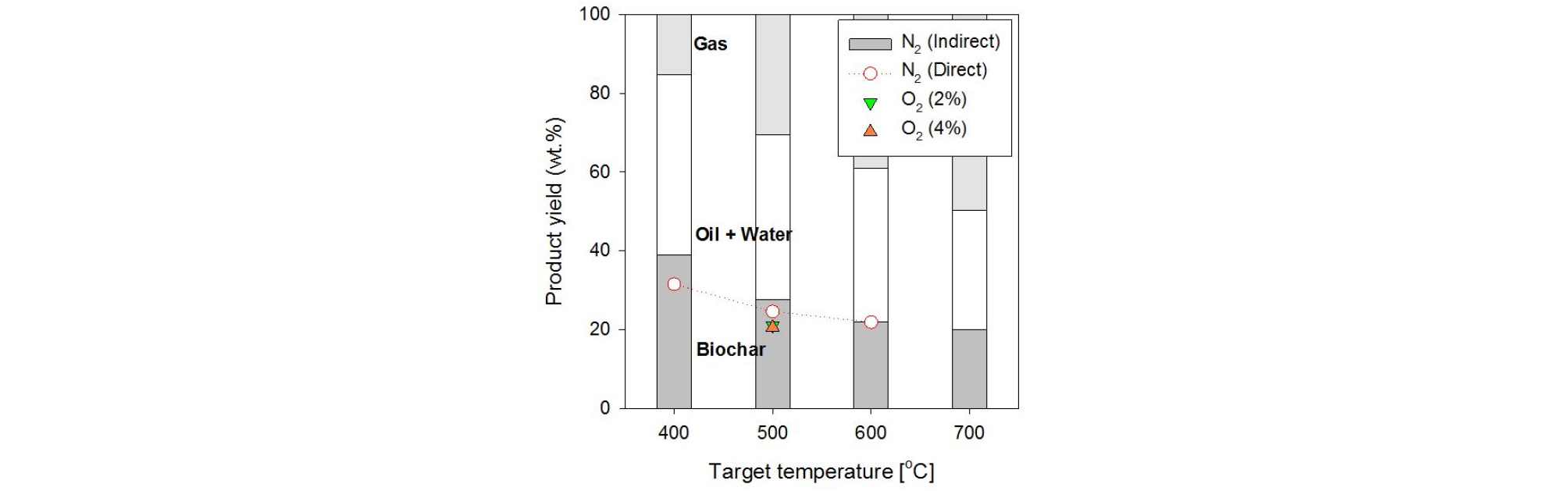
Fig. 4는 열분해 실험 조건에 따른 생성물의 수율을 그래프로 나타낸 것이다. 먼저, 열분해 온도가 높을수록 바이오차의 수율이 감소하였으며, 상대적으로 낮은 온도 범위에서 수율의 감소가 더 크게 나타났다. 이는 앞선 TGA 결과를 통해 유추할 수 있으며 상대적으로 낮은 온도(400℃)에서는 셀룰로오스가 완전히 분해되지 않고 잔류하기 때문이다. 이후 온도가 높을수록 잔류 리그닌의 분해가 점진적으로 진행되며 바이오차의 수율이 감소하는 것을 확인할 수 있다. 또한 온도가 높을수록 상대적으로 가스의 수율이 증가하는 경향을 나타냈으며, 700℃ 이상의 온도범위에서는 열분해 오일(타르)의 추가적인 분해가 활발히 일어나며 가스로의 전환이 두드러지게 나타났다.
이러한 본 실험의 결과는 Chen이 수행한 300~500℃ 범위에서 white ash, switch grass와 corn stover의 열분해 실험 결과와 유사한 경향을 나타냈다[7]. 반면 Park의 연구에서는 회분 함량이 22.6%로 높은 rice straw의 경우 300~700℃ 범위에서 바이오차의 수율만 감소하고 나머지는 증가하는 경향을 보였다[8]. Qu 등[14]에 따르면 목질계 바이오매스(lignocellulosic biomass)와 구성물질(셀룰로오스, 헤미셀룰로오스, 리그닌)은 열분해 온도 증가에 따라 휘발분의 증발과 탄화가 일어나지만, 일정 온도 이상에서는 불안정한 휘발분의 크래킹으로 인해 오일의 수율은 특정 온도대에서 최대값을 가지는 것으로 보고된 바 있어, 실험 조건 중간 영역 등에서 오일 수율이 최대가 될 수 있다.
같은 온도 조건에서 직접열교환 방식의 경우 간접열교환 방식보다 바이오차의 수율이 더 낮게 나타났는데 앞선 Fig. 3에서 확인한 바와 같이 고온의 이송가스와 바이오매스의 직접 접촉으로 인해 투입 초기 승온이 빠르게 진행되었기 때문이다.
반면, 이송가스에 산소가 포함될 경우 Fig. 3에나타낸 바와 같이 열분해와 동시에 일어나는 부분적 산화반응으로 반응기 내부 온도가 상승하기 때문에 같은 반응기 설정 온도 조건에서 산소가 없는 경우보다 낮은 바이오차 수율(열분해가 더 많이 진행됨)을 나타냈다.
3.4. 바이오차 특성 분석
Table 3은 열분해 실험 조건에 따른 바이오차의 기초 특성분석 결과를 나타낸 것이다. 열분해 온도가 높을수록 바이오차 내에 잔류하는 휘발분의 함량이 크게 감소하고 상대적으로 고정탄소 함량이 증가하였으며, 원소조성에서도 상대적으로 탄소 함량이 크게 증가하여 발열량이 증가하는 것을 확인할 수 있었다. 열분해 온도 500℃ 이상에서 모든 조건에 대해 바이오차의 탄소 함량은 86.5% 이상이었으며, 같은 온도 조건에서 열교환 방식이나 산소 농도에 따라 최대 90.8% 까지 나타났다. 또한, 원료 바이오매스 대비 발열량은 500℃ 기준 73~80% 상승하여 일반적인 역청탄 이상의 발열량(24~35 MJ/kg) 수준인 것으로 나타났다. 탄소함량은 바이오차를 제철공정의 코코스 대체, 전극소재 활용 및 탄소 고정에 활용하는 경우에 중요해진다.
Table 3. Properties of biochar by experimental conditions
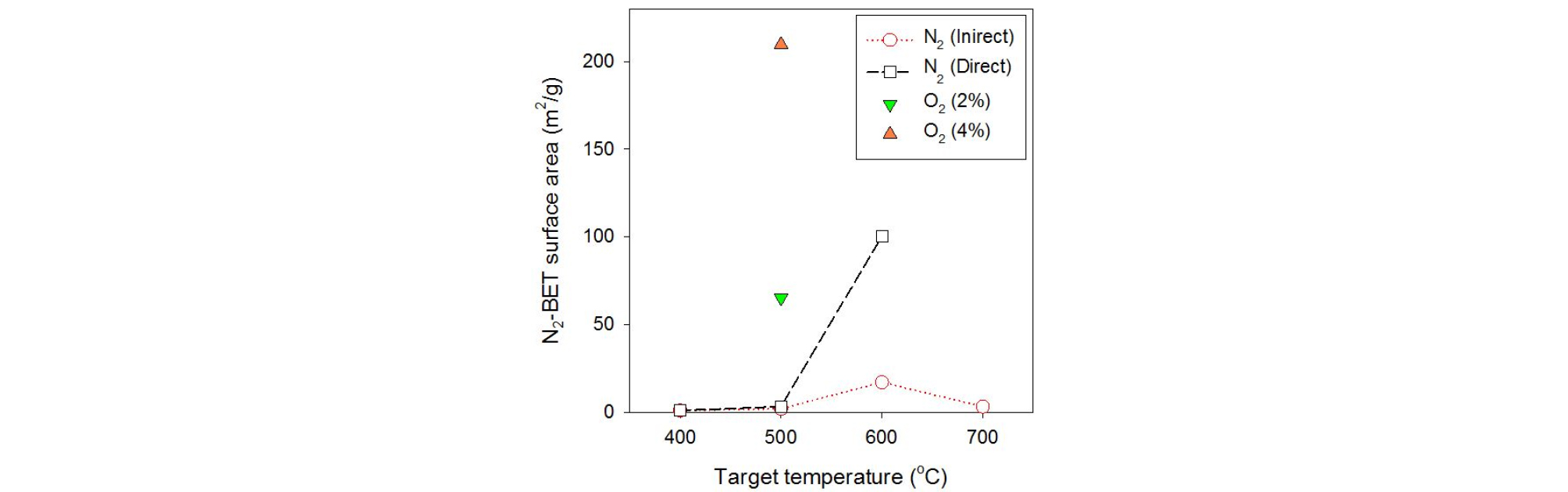
바이오차의 활용 시 중요한 요소인 비표면적을 실험 조건별로 Fig. 5에 나타냈다. 바이오차 내부의 미세기공 형성에 의해 발달한 비표면적은 연소/가스화 속도를 결정하는 반응성, 토양 개량제 및 흡착제로서의 활용 시 무기물 및 오염물질의 흡착성능을 결정하는 중요한 특성이다. 바이오차의 미세 비표면적은 500℃ 이상에서 급격히 발달하는 것을 확인할 수 있었다. 간접열전달 방식의 경우 500℃ 이상에서 비표면적이 발달하다가 700℃에서 감소하였는데, 이는 열분해 과정에서 탈휘발되어 방출된 타르 성분이 느린 유속 탓에 바이오차 표면과 기공에 흡착되는 영향이 크기 때문으로 판단된다. 반면 직접열교환 방식의 경우 열분해가 더 활발히 진행되며 비표면적이 더 발달한 것을 나타냈다. 이송 가스 포함된 산소는 바이오매스 외부와 형성된 기공으로 확산되어 열분해 증기의 부분 산화를 유발한다[14]. 따라서 열분해 온도 상승 효과가 발생하고 결과적으로 비표면적이 추가적으로 더 발달하였다.
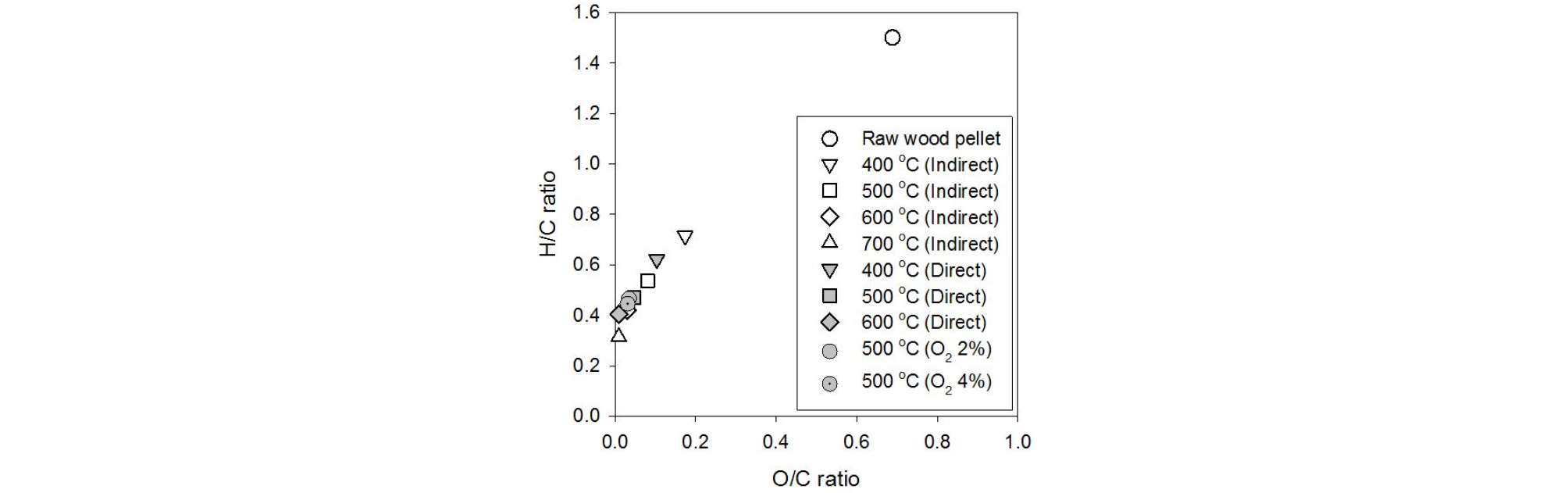
Fig. 6은 우드펠릿 원료와 이를 이용하여 다양한 조건에서 생성된 바이오차의 원소 조성에 대해 Van Krevelen diagram을 도시한 것이다. 그래프에서 원점에 가까울수록 상대적인 탄소 함량이 높다는 것을 의미하며 원점은 탄소 100%를 의미한다. 그래프에서 확인할 수 있듯 원료 바이오매스 대비 모든 열분해 조건에서 생성된 바이오차의 상대적인 탄소함량이 증가하는 것을 확인할 수 있다. 열분해 온도가 높을수록 또는 직접열교환 방식일 경우 원점에 근접하는 경향(상대적인 탄소 함량이 증가)을 나타냈으며, 이를 통해 바이오차의 열분해 정도를 대략적으로 평가할 수 있다. 또한, 산소가 포함된 경우 앞선 결과에서와 마찬가지로 동일한 설정 온도 대비 높은 열분해 정도를 나타냈다.
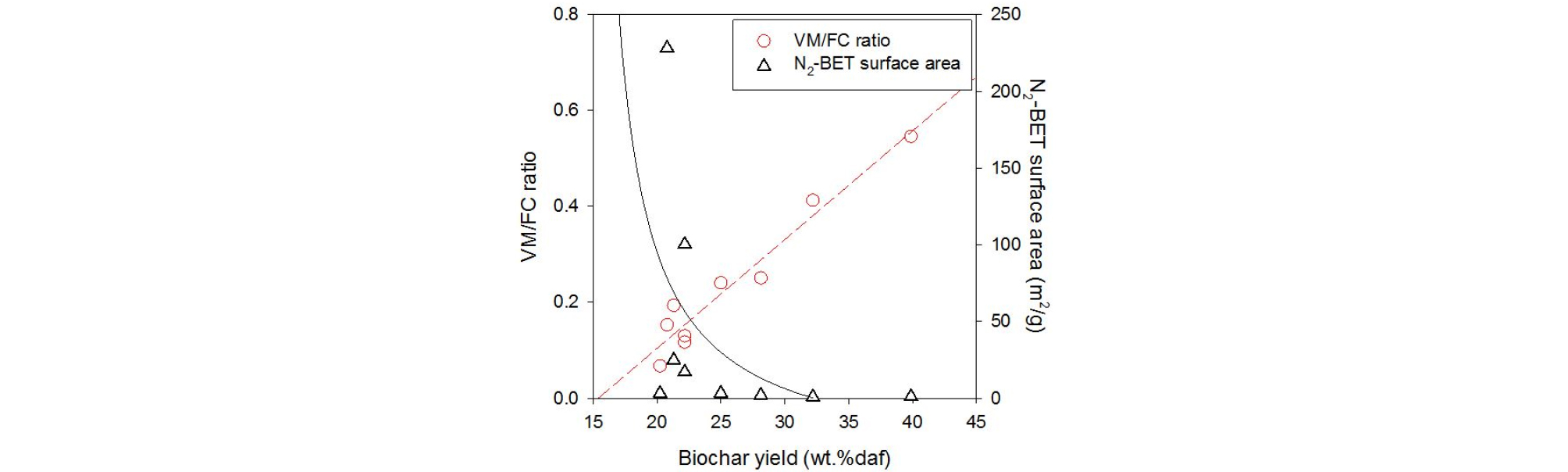
Fig. 7은 VM/FC 비율 및 비표면적을 운전 조건과 상관없이 생성된 바이오차의 수율에 대하여 나타낸 것이다. VM/FC 비율은 바이오차 수율에 대하여 선형적으로 감소하는 것을 확인할 수 있다. 이는 바이오차의 수율이 생성된 바이오차의 특성을 결정하는 중요한 지표로 사용될 수 있다는 것을 의미한다. 비표면적의 경우 선형적인 관계를 가지지는 않지만, 일정 수율 이하에서 급격히 발달하는 것을 보여준다. 생성된 바이오차의 비표면적은 수율 22% 미만에서 일부 발달하는 것을 확인할 수 있으며, 수율을 20% 미만으로 열분해 시 바이오차의 비표면적을 충분히 증가시킬 수 있을 것으로 판단된다.
3.5. 바이오오일 특성 분석
Table 4는 간접열분해 실험에서의 바이오오일의 특성을 나타낸 것이다. 400℃ 온도 열분해 시 수분을 제외한 오일 성분에서의 탄소 함량은 52.0%였으며, 700℃ 열분해 시 34.6%로 감소하였다. 이는 온도 상승의 따라 열분해 반응이 및 타르의 크래킹이 활발해지기 때문인 것으로 판단된다. 마찬가지로 바이오오일 내 포함되는 수분의 양은 열분해 온도 상승에 따라 증가하여서 400℃에서 47.5%, 700℃에서 63.9%로 나타났다.
Table 4. Bio-oil properties (Indirect)
| Target temp. (℃) | Ultimate analysis (wt.% dry) | Moisture (%) | |||
| C | H | O* | N | ||
| 400 | 52.0 | 5.6 | 42.0 | 0.4 | 47.5 |
| 500 | 46.1 | 5.3 | 48.2 | 0.5 | 53.6 |
| 600 | 43.1 | 4.8 | 51.8 | 0.4 | 53.1 |
| 700 | 34.6 | 9.9 | 54.9 | 0.7 | 63.9 |
3.6. 비응축성 가스 특성 분석
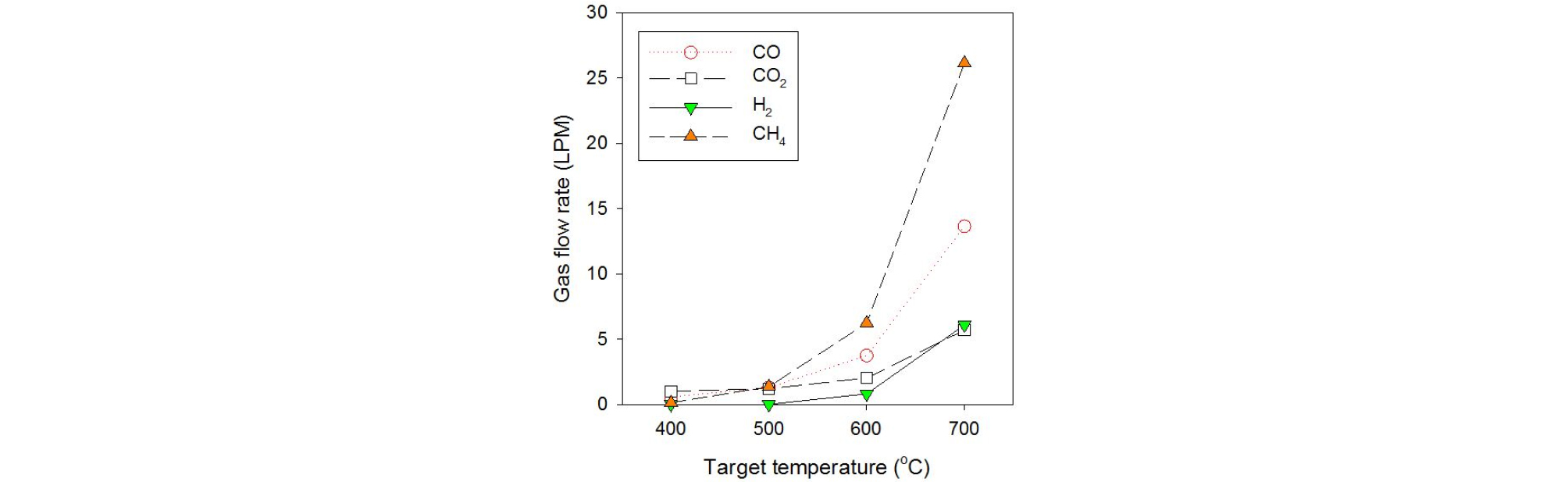
Fig. 8은 간접 열분해 시 반응기 정상상태에서 배출되는 비응축성 가스의 성분별 유량을 나타낸 것이다. CO와 CO2는 셀룰로오스, 헤미셀룰로오스와 리그닌의 분해 과정에서 높은 비율로 발생된다. CH4은 리그닌, H2는 셀룰로오스와 헤미셀룰로오스의 분해 과정에서 주로 발생한다[15]. 400~500℃의 열분해 시 바이오매스의 카르보닐(C=O) 및 카르복실(COO) 그룹의 분해 및 리포밍으로 인해 생성되는 CO 및 CO2가 배출 가스의 대부분을 차지한다[15]. 400℃에서는 CO2의 배출량이 CO보다 높지만, 500℃ 이상의 온도에서는 CO의 배출량이 CO2보다 많아지는 것을 확인할 수 있다. CH4의 경우 500℃ 이상의 온도에서 열분해 시 배출량이 급격하게 증가하며, 700℃ 이상의 온도에서는 H2의 배출량이 증가하는 것을 확인할 수 있다.
열분해 온도가 상승함에 따라 비응축성 가스의 수율이 증가함과 동시에 저열량의 가스(CO) 대신 CH4 및 H2 의 배출의 증가하기 때문에 열분해 온도 상승에 따라 생성 가스의 에너지원을 효율적으로 활용할 필요가 있다.
결론
본 연구에서는 우드펠렛을 대상으로 연속식 스크류 열분해 반응기를 활용하여 다양한 실험 조건에서 저속열분해 실험을 수행하였고, 각각 열분해 생성물의 특성을 분석하였다.
간접열교환의 온도 증가는 원료의 열적 분해 정도를 증가시켜 생성물의 수율과 특성에 영향을 주었다. 고온의 이송가스가 열전달 매체가 되는 직접열교환 방식은 열전달 효율성을 증가시켜 바이오매스의 열분해 정도가 촉진되는 것을 확인하였다. 이에 따라 동일한 열분해 온도에서 간접열교환 대비 열분해 정도가 증가하여 바이오차의 수율이 감소하며, 탄소의 함량이 증가하였다. 특히 바이오차 표면의 기공이 발달하여 비표면적이 확연하게 높아지는 것을 확인하였다.
직접 열교환 시 투입 가스에 O2가 포함되어 있을 경우, 열분해 증기의 부분 산화로 인해 내부온도가 상승하여 N2 분위기의 실험 대비 바이오차의 수율이 낮고 탄소함량이 높게 나타났다. 부분 산화 분위기에서 생성된 바이오차의 비표면적은 충분히 발달하여 토양 개량제나 저급 활성탄으로 활용될 가능성이 있다. 에너지 자체 공급 측면 및 바이오차 특성에서 장점이 있는 부분 산화 열분해 공정은 공정 안정성과 생성물의 품질 제어 측면에서 추가적인 연구가 필요하다.
열분해 온도가 증가함에 따라 타르 크래킹으로 인해 오일의 수율과 탄소 함량과 발열량이 감소하였다. 반면 저온 열분해 시 CO, CO2 등의 저열량의 가스가 배출량의 대부분을 차지하는 것에 대비하여 고온 열분해 시 CH4 및 H2 의 배출량의 증가가 가속화되어 효율 증가를 위해 생성된 오일과 가스 에너지를 재생하는 시스템이 요구된다.
연속식 바이오매스 열분해 생성물의 수율, 화학적 조성, 물리적인 특성에 다양한 변화가 발생되므로, 실제 공정은 바이오차, 바이오오일, 비응축성 가스의 효율적인 활용 방법에 맞게 설계되어야 한다.