1. 서 론
2. 실험 및 전산 시뮬레이션
2.1 실험 재료
2.2 열중량 분석 (Thermogravimetric Analysis, TGA)
2.3 반응속도론적 분석(Kinetic Analysis)
2.4 화재 시뮬레이션 (Fire Dynamics Simulator, FDS)
3. 실험 및 전산 시뮬레이션 결과
3.1 열분해 특성
3.2 반응속도론적 변수
3.3 열분해 반응 모델링
4. 결 론
1. 서 론
전 세계적으로 에너지 절약에 대한 관심이 증가하고 있다. 전체 에너지 소비 중 건축물에서의 에너지 소비가 약 30-40% 차지한다[1]. 건축물에서는 외부로의 에너지 손실을 줄이기 위해 온도 조절 용도로 단열재가 사용된다. 또한, 단열 효과가 뛰어난 유기 단열재는 비용이 저렴하고 시공이 편리하여 건축 자재로도 널리 사용된다. 그러나, 유기 단열재는 가연성 물질로서 열원에 노출되면 쉽게 연소한다. 또한, 화재 시 화염 전파가 빠르고, 다량의 연기와 유독가스를 배출하여 심각한 인명피해 및 재산피해를 초래한다. 2022년 건축법을 개정하여 유기 단열재 사용이 제한되었지만[2], 개정 이전 건축물은 여전히 화재에 노출되어 있다. 따라서, 단열재로 인한 화재 위험성을 줄이기 위해 화재 발생 과정을 분석하는 것은 중요하다.
단열재는 고체 연료로서, 열원에 노출되면 표면에서 물리적 변화인 상변화 또는 화학적 변화인 열분해를 통해 연소한다. 열분해로 인해 표면에서 가연성 기체나 저분자 물질이 생성되어 주변 공기와 만나 가연성 혼합기를 형성한다. 점화원이 존재할 때 발화 온도에 도달하면 점화하고 연소하게 된다. 또한, 연소로 생성된 열은 표면에 재공급되어 화재가 성장하게 된다. 따라서, 고체 연료의 열분해 과정은 화재 성장에 영향을 미치는 주요 요인이므로 연소 및 화재를 해석하기에 앞서 반드시 열분해 과정에 대한 이해가 이루어져야 한다.
국내에서 점화 이전 열분해 과정을 분석하는 연구가 일부 진행되었다. Chun et al.[3]은 경질 및 연질 폴리우레탄 폼의 형태에 따른 열분해 반응속도를 분석하여 정량적으로 비교했다. 화학적 조성의 차이로 인해 연질 폴리우레탄 폼의 평균 활성화에너지가 경질 폴리우레탄 폼의 활성화에너지보다 약 1.59배 크다고 결론지었다. 국외에서는 열중량 분석을 통해 열분해 특성을 분석하는 연구가 많이 수행되고 있다. Bilbao et al.[4]은 질소와 공기 환경에서 폴리우레탄 폼의 열분해 반응을 비교하였고, 가스 환경에 따라 열분해 과정이 다르게 나타나는 것을 보였다. Xu et al.[5]은 폴리우레탄 단열재의 열분해 과정에서 발생하는 가스 생성물과 반응속도론적 변수를 분석하였다. Distributed activation energy model(DAEM) 법이 열분해 과정을 표현하기에 적합한 방법이라고 하였다. 다량의 가스 생성물이 120-500°C에 방출되며, 각 성분이 생성되는 주요 온도 범위를 제공하였다. Pau et al.[6]은 난연 여부에 따른 폴리우레탄 폼의 열분해 거동을 조사하였다. 활성화에너지와 선인자 계수를 산출하기 위해 세 가지 그래프 기법을 적용하였고, 온도에만 영향을 받는 열분해 모델에 더 적합한 방법을 제시하였다. Yao et al.[7]은 폴리우레탄 폼의 열분해 반응속도를 조사하였다. Model-free 법, model-fitting 법, DAEM 법을 사용하여 산출된 활성화에너지를 정량적으로 비교하였고, 폴리우레탄 폼의 열분해 과정을 나타내는 데 적절한 방법론을 제시했다. 대부분의 연구는 실험 조건 변화에 따라 정량적으로 비교하는 데에 초점을 두고 있다.
화재 관점에서 열분해 과정을 분석하는 연구가 일부 수행되고 있다. Prasad et al.[8]은 폴리우레탄 폼을 대상으로 Fire Dynamics Simulator(FDS)를 이용하여 화염 확산을 예측하기 위한 적절한 모델을 제안하고자 하였다. 화염 확산을 시뮬레이션하기 위해 5, 10°C/min의 2가지 승온속도 조건에서 수행한 실험을 통해 반응속도 변수를 산출하였다. 화염 확산에 대한 화재 시뮬레이션과 실험 결과를 비교하였고, 화재 시뮬레이션을 통해 예측된 화염 확산 속도가 최소 2배 빠른 것으로 나타났다. International Confederation for Thermal Analysis and Calorimetry(ICTAC)에 따르면, 최소 3-5개의 승온속도 조건에서 수행된 실험을 기반으로 유도된 반응속도론적 변수가 더 정확하다고 알려져 있다[9]. Mckeen et al.[10]은 FDS 열분해 모델을 사용하여 연질 폴리우레탄 폼의 화재 거동을 예측하고자 했다. 콘 칼로리미터 실험의 열방출률 결과와 시뮬레이션 예측 결과를 비교하여, 기존 두 가지 층(two-layer) 모델을 수정하여 새로운 혼합된 층(mixed-layer) 모델을 제안하였다.
화재 현상을 3차원으로 구현하기 위해 미국의 National Institute of Standards and Technology(NIST)에서 개발한 FDS가 널리 사용된다[11,12]. FDS는 열분해 현상을 고려하여 화재를 해석하는 열분해 모델이 있지만, 물질의 정확한 열분해 물성값과 기체 상태의 반응 해석이 요구된다. 대부분의 연구는 열분해 현상을 고려하지 않고 열방출률을 입력하는 단순 모델을 사용하고 있다. 하지만, 실제 고체 연료에서 생성되어 발생하는 기체가 주변 환경과 반응하여 화재 확산, 화염 전파와 같은 현상이 나타날 수 있다. 이러한 현상이 시뮬레이션을 통해 구현되기 위해서는 정확한 열분해 모델이 활용되어야 한다.
본 연구는 화재 모델링 시 열분해 모델을 적절하게 활용하기 위한 선행 연구이다. 화재 관점에서 고체 연료가 가연성 기체로 분해되는 열분해 과정을 해석하고, 열분해 모델링 방안을 제시하고자 하였다. 열중량 분석(Thermogravimetric analysis, TGA) 실험을 수행하여 열분해 온도 범위를 측정하였다. TGA 실험을 기반으로 반응속도를 분석하고, 반응속도에 영향을 미치는 변수인 활성화에너지와 선인자 계수를 결정하였다. 마지막으로, FDS 열분해 모델을 사용하여 유도된 반응속도론적 변수가 열분해 과정을 적절하게 예측할 수 있는지 검토하였다.
2. 실험 및 전산 시뮬레이션
2.1 실험 재료
본 연구에서 사용한 실험 재료는 유기 단열재 종류인 폴리우레탄 폼이다. 폴리우레탄 폼은 이소시아네이트(isocyanate)와 폴리올(polyol)이 반응하여 우레탄 결합을 형성하여 생성된다[13]. 즉, 2가지 성분으로 구성된 폴리우레탄 폼의 열분해 특성을 조사하였다.
2.2 열중량 분석 (Thermogravimetric Analysis, TGA)
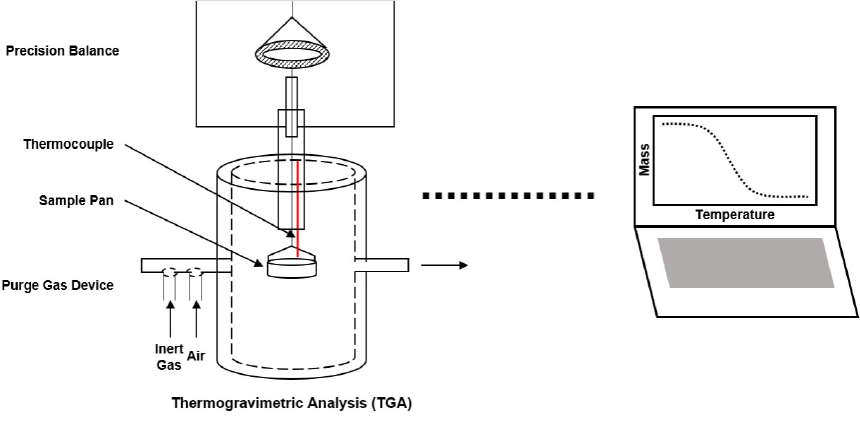
고체 가연물의 열분해 특성을 분석하기 위해 열중량 분석 실험이 널리 사용된다. TGA라고 불리는 열중량 분석은 온도나 시간에 대한 시편의 질량 변화를 측정하는 방법으로, Fig. 1에 TGA 장치 개략도를 나타내었다. TGA 실험을 수행하면 thermogravimetric(TG) 곡선과 이를 미분한 derivative thermogravimetric(DTG) 곡선이 제공된다. TG 곡선은 온도에 대한 질량 변화를, DTG 곡선은 온도에 대한 질량 변화율을 나타낸다. 두 곡선으로부터 열분해 반응이 최대 속도로 일어나는 지점 온도와 열분해 온도 범위가 나타난다.
본 연구에서는 TA instruments에서 제작한 discovery TGA 55를 사용하여 TGA 실험을 수행하였다. 사용된 장치 사양에 대해서는 Table 1에 나타내었다. Table 2에 실험 조건을 나타내었다. 실험에 사용된 시편의 질량은 약 5 mg이며, 실험 온도 범위는 상온에서 800°C까지 일정한 승온속도로 증가하도록 설정하였다. 이때 승온속도는 5, 10, 15, 20°C/min으로 4가지 조건을 적용하였다. 주입 가스로는 불활성 기체인 질소를 사용하여 산화 반응을 고려하지 않고 열분해 과정을 해석하였다. 또한, 실험 결과의 정확성을 확보하기 위해 각 실험은 모두 3회 반복 수행하였다.
Table 1.
Specifications of TGA instrument
Table 2.
Experimental conditions
| Condition | Description |
| Mass | ∼ 5 mg |
| Temperature range | 20―800°C |
| Heating rate | 5, 10, 15, 20°C/min |
| Purge gas | Nitrogen (N2) |
2.3 반응속도론적 분석(Kinetic Analysis)
열분해 반응속도는 가연성 기체의 생성과 연소 반응을 결정하므로 정확하게 예측되어야 한다. 일반적으로 열분석에서 반응속도를 분석하기 위해 반응속도론적 분석이 사용된다. 반응속도(r)는 전환도(extent of conversion)의 시간에 대한 변화를 나타내는 전환율과 같으며, 식 (1)과 같다[9].
여기서, α는 전환도로서 식 (2)과 같이 나타난다.
식 (2)에서 ms와 mf는 실험 시작 및 종료 시점의 질량이며, mt는 실험 중 측정된 질량이다. 즉, 전환도는 TGA 실험 중 전체 질량 변화에 대한 해당 시점에서의 질량 변화이다. 또한, 식 (1)의 f(α)는 전환도에 대한 반응함수이며, k(T)는 반응속도 상수로서 Arrhenius 형태로 식 (3)으로 표현된다.
식 (3)에서 R은 일반 기체 상수(8.3143 J/mol·K), T는 표면 온도(K)이다. 또한, A와 Ea는 각각 선인자 계수(pre- exponential factor)와 활성화에너지(activation energy)로 반응속도론적 변수이다. 식 (3)을 식 (1)에 대입하여 정리하면, 식 (4)이 도출된다.
일반적으로 식 (4)은 반응속도론적 분석에서 반응속도론적 변수를 산출하는 데에 사용된다. 식 (4)을 기반으로 여러 분석 방법론이 제안되었다. 분석 방법론은 반응 메커니즘 고려 유무에 따라 model-free 법과 model-fitting 법으로 나뉜다. 먼저, model-free 법은 반응 메커니즘을 고려하지 않고 반응에 대한 활성화에너지를 산출할 수 있다는 장점이 있지만, 선인자 계수의 산출이 어렵다. 반면에, 반응 메커니즘을 고려하는 model-fitting 법은 활성화에너지와 선인자 계수를 계산할 수 있다. 그러나, 반응 메커니즘이 알려지지 않으면 적용이 어렵다. 따라서, 본 연구에서는 model-free 법과 model-fitting 법을 동시에 적용하여 반응속도론적 변수를 산출하고자 한다.
2.3.1 Model-free 법
활성화에너지를 산출하기 위해 많은 model-free 법이 제안되었고, 어떠한 분석법을 사용하는지에 따라 정량적으로 다르다[14,15]. 단일 model-free 법을 사용하여 활성화에너지를 결정하는 것은 정확도가 낮다. 본 연구에서는 Kissinger 법, Flynn-Ozawa-Wall(FWO) 법, Kissinger- Akahira-Sunose(KAS) 법, Starink 법을 사용하여 활성화에너지를 계산하고 정량적으로 비교하였다. Model-free 법은 여러 승온속도(β)에서의 실험 결과를 바탕으로 활성화에너지를 결정한다.
Kissinger 법[16,17,18]은 전체 열분해 과정에 대해 최대 반응 온도(Tp)를 기준으로 일정한 활성화에너지를 산출한다. 식 (4)으로부터 반응함수의 반응 차수를 1차로 가정하면 식 (5)과 같이 나타난다.
Kissinger 법에서 활성화에너지는 y축에 ln(β/Tp2), x축에 1000/Tp를 도시하여 선형적인 관계를 갖는 경우 기울기인 –Ea/R로부터 산출된다.
Kissinger 법과 달리 FWO[19,20], KAS[16,21], Starink [22] 법은 열분해 과정의 전환도가 활성화에너지에 영향을 미친다고 고려하여 전환도에서의 활성화에너지를 산출한다. 식 (4)을 적분하고 근사식을 이용하면 FWO, KAS, Starink 법은 각각 식 (6), 식 (7) 및 식 (8)으로 표현된다.
식 (6), (7), (8)의 g(α)는 전환도에 대한 반응함수를 적분한 것이며, Tα는 전환도에서의 온도이다. 식 (6)의 FWO 법에서 활성화에너지는 y축에 ln(β), x축에 1000/Tα를 표시하였을 때 나타나는 기울기인 –1.0518Ea/R로부터 구할 수 있다. 식 (7)의 KAS 법에서 활성화에너지는 y축에 ln(β/Tα2), x축에 1000/Tα를 도시하여 나타나는 선형적인 기울기인 –Ea/R로부터 결정된다. 식 (8)의 Starink 법에서 활성화에너지는 y축에 ln(β/Tα1.92), x축에 1000/Tα를 나타내었을 때 직선의 기울기인 –1.0008Ea/R로부터 계산된다.
2.3.2 Model-fitting 법
본 연구에서는 반응 메커니즘을 결정하기 위해 model- fitting 법 중 가장 널리 사용되는 Coats-Redfern(CR) 법을 사용하였으며, 식 (9)과 같이 표현된다[23].
Table 3에 반응속도론적 분석에서 흔히 사용되는 고체 상태의 전환도에 대한 반응 적분 메커니즘 g(α)를 나타내었다[9,24]. Table 3에 제시된 반응 메커니즘을 식 (9)에 대입하여 각각의 승온속도에 대한 실험 결과를 y축 ln(g(α)/T2), x축 1000/T에 대해 나타내었을 때 선형적인 관계를 갖는다면, 활성화에너지는 선형적인 관계의 기울기인 –Ea/R로부터 산출된다. 결정된 model-fitting 법의 활성화에너지를 model-free 법의 활성화에너지와 비교하여 유사한 반응 메커니즘을 결정할 수 있다. 반응 메커니즘과 각 승온속도에서의 활성화에너지가 결정되면, 선형적인 관계의 y 절편에 해당하는 값인 ln(AR/βEa)으로부터 선인자 계수가 계산된다.
Table 3.
Reaction integral mechanism of solid-state used in kinetic analysis
2.3.3 반응속도론적 보상 효과 (Kinetic Compensation Effect)
앞서 언급한 대로, model-free 법에서 선인자 계수를 계산하는 것은 어렵다. 그러나 반응속도론적 보상 효과를 적용하면 model-free 법의 선인자 계수를 계산할 수 있다. 반응속도론적 보상 효과는 활성화에너지와 선인자 계수의 자연로그 값 간의 관계가 선형적인 것을 의미하며, 식 (10)으로 표현된다[9].
여기서 Ai와 Ei는 각각 model-fitting 법을 통해 결정된 각 승온속도에서의 활성화에너지와 선인자 계수이다. a와 b는 보상 계수로서 승온속도에 영향을 받으며, Ai와 Ei로부터 결정된다. 보상 계수가 결정되면, 식 (10)은 model-free 법에 대해 식 (11)으로 다시 나타낼 수 있다.
식 (11)에 model-free 법을 통해 결정된 활성화에너지(E0)를 대입하면, 최종적으로 model-free 법의 선인자 계수(A0)가 유도된다.
2.4 화재 시뮬레이션 (Fire Dynamics Simulator, FDS)
본 연구에서는 화재 관점에서의 고체 연료 열분해 과정을 모델링하기 위해 화재 시뮬레이션인 FDS를 사용하였다. FDS는 미국 표준기술연구소(NIST)에서 개발한 전산유체역학(computational fluid dynamic, CFD) 소프트웨어이다. FDS는 Navier-Stokes 방정식을 기반으로 화재에 의해 발생한 열적 유동을 해석하여 3차원으로 모델링한다.
FDS에서는 열분해 모델을 통해 열분해 과정을 고려할 수 있다. FDS 열분해 모델을 사용하면 가연성 기체의 반응을 고려하기 때문에 화재 확산 및 화염 전파와 같은 복잡한 화재 현상을 정확하게 예측할 수 있다고 알려져 있다. FDS 열분해 모델은 고체 표면에서 가연성 기체가 생성되는 반응속도(rs)를 식 (12)을 통해 예측한다[11,12].
여기서 ρs는 고체 밀도, R은 기체 상수, Ts는 고체 표면 온도이다. n은 반응 차수로, FDS에서는 기본값으로 1을 사용하며, 반응 메커니즘으로부터 결정된다. A와 Ea는 각각 선인자 계수와 활성화에너지이며, TGA 실험에서 유도된 열분해 물성값이다. 본 연구에서는 실험에서 유도된 물성값을 FDS의 0차원 열분해 모델에 적용하여 예측된 결과와 실험 결과를 비교하였다.
3. 실험 및 전산 시뮬레이션 결과
3.1 열분해 특성
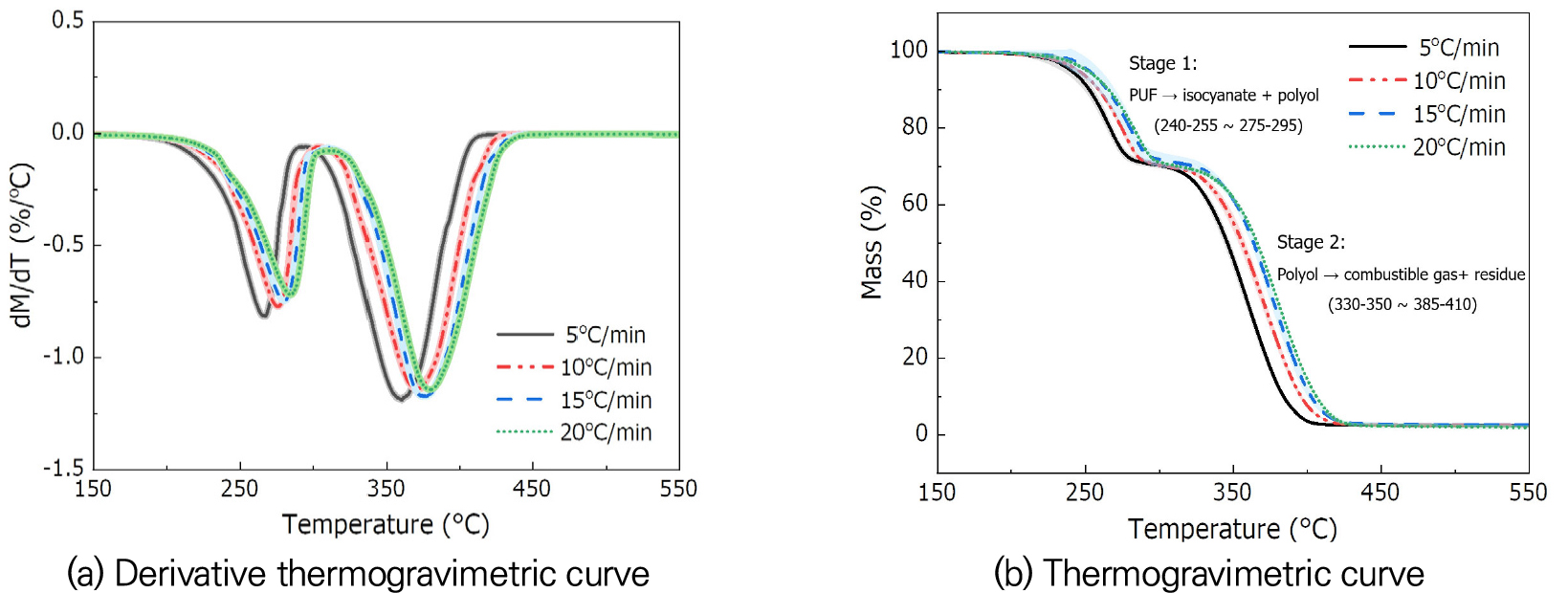
Fig. 2는 폴리우레탄 폼의 다양한 승온속도에서 TGA 실험 결과이다. Fig. 2(a)는 DTG, Fig. 2(b)는 TG 곡선이다. 승온속도가 증가함에 따라 곡선이 오른쪽으로 이동하는 경향이 나타난다. 이것은 승온속도가 증가할수록 시편으로 열이 제공되는 시간이 짧아져 열분해가 일어나는 데에 필요한 열을 공급받는 시간이 지연되어 나타나는 현상이다[25,26]. 즉, 승온속도가 증가하면 열분해가 더 높은 온도에서 시작되고 종료되는 것이다.
Fig. 2(a)에서 확인할 수 있듯이, 해당 온도 범위의 DTG 곡선 내 두 번의 최저점이 나타났다. DTG 곡선의 최저점 수는 특정 온도 범위에서 물질이 겪는 주요 반응 단계의 수를 나타낸다. 폴리우레탄 폼은 다중 반응, 즉 두 번의 반응을 통해 열적 변화를 겪는다. Fig. 2(b)에서도 두 번의 뚜렷한 질량 감소를 나타낸다. 따라서, 폴리우레탄 폼의 열분해는 2단계 반응으로 해석되어야 한다. 첫 번째와 두 번째 질량 감소가 나타나는 구간에 대해 각각 stage 1, stage 2로 표시하였다. Stage 1에서는 약 25%, stage 2에서는 약 55%의 질량이 감소하였다. 이는 폴리우레탄 폼 내 이소시아네이트와 폴리올의 질량 비율이 각각 25%, 55%임을 의미한다.
DTG 곡선의 최저점에서 열분해 반응이 최대 속도로 일어나는 지점 온도를 얻을 수 있으며, 이는 최대 반응 온도이다. 또한, 최대 반응 온도를 기준으로 ISO 11358-1[27]을 적용하여 열분해 온도 범위가 나타난다. Table 4에 열분해 시작, 종료 온도와 최대 반응 온도를 정리하여 나타냈다. 앞서 언급한 바와 같이, 승온속도가 증가함에 따라 열분해 온도가 더 높아지는 것을 확인할 수 있다. 이전 연구에 따르면[28], 폴리우레탄 폼은 열원에 노출되면 초기에 폴리올과 기체 상태의 이소시아네이트로 분해된다. 그런 다음, 분해된 폴리올이 반응 온도에 도달하면 연소성 기체와 잔여물로 남는다. 폴리올과 이소시아네이트로 분해되는 반응에 해당하는 stage 1은 약 240-255°C에서 시작되고, 275-295°C에서 종료된다. 폴리올이 분해되는 반응에 해당하는 stage 2는 약 330-350°C에서 시작되고, 385-410°C에서 종료된다.
Table 4.
Pyrolysis start, peak, and end temperatures of polyurethane foam in each stage
3.2 반응속도론적 변수
3.2.1 활성화에너지
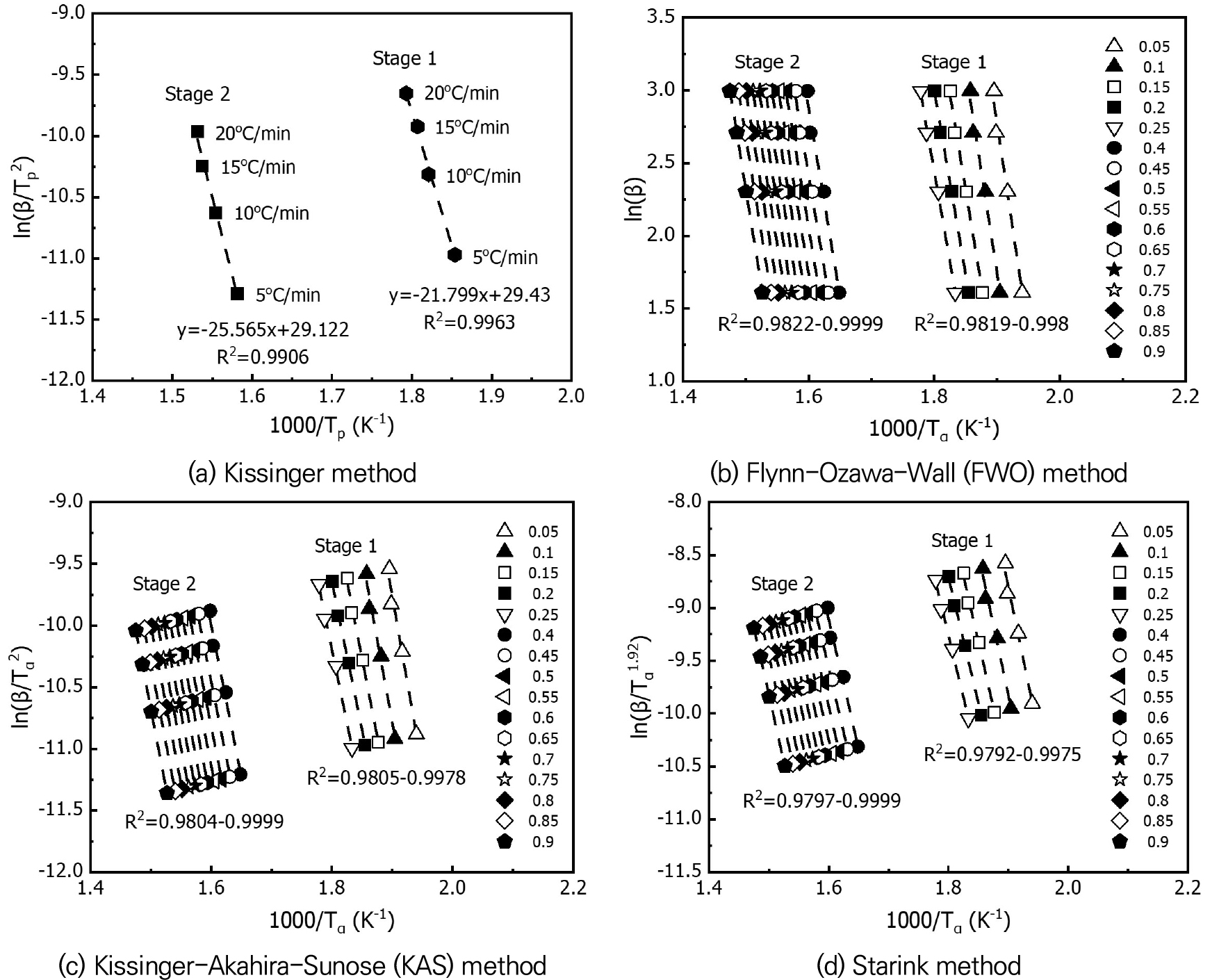
Fig. 3은 4가지 model-free 법에서 x축과 y축에 대하여 실험 결과를 도시한 결과이다. Kissinger 법은 최대 반응 온도를 기준으로 도시하였다. FWO, KAS, Starink 법의 경우, 전환도를 고려하기 때문에 0.05-0.9 범위에 대해 5% 간격으로 표현했다. 상관계수가 1에 가까울수록 선형적인 관계를 갖는 것을 의미한다. 4가지 방법론 모두 상관계수가 0.97 이상의 값을 보이므로, 4가지 방법론을 통해 활성화에너지를 산출하는 것은 적절하다.
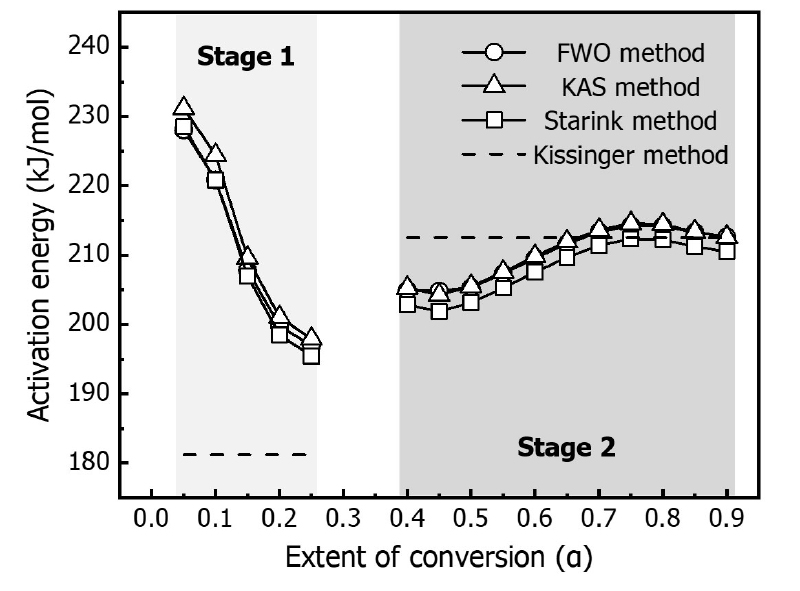
Fig. 4는 선형적인 관계의 기울기로부터 산출된 전환도에 대한 활성화에너지를 나타낸 것이다. Kissinger 법은 전체 반응에 대해 일정한 활성화에너지를 가지므로 점선으로 표시하였다. 먼저, Kissinger 법의 선형화로부터 계산된 활성화에너지는 stage 1에 대해 181.243 kJ/mol, stage 2에 대해 212.555 kJ/mol이다. 이는 이소시아네이트와 폴리올의 결합력이 상대적으로 약하기 때문에 작은 에너지로 분해될 수 있음을 의미한다. FWO, KAS, Starink 법을 통해 산출된 활성화에너지는 전환도에 따라 변하는 것으로 나타났다. 전환도를 고려하는 경우, stage 1에서는 초기 열분해 반응(α=0.05)에 가장 큰 활성화에너지를 보이며 점차 감소하였다. 이는 열에 노출되었을 때 초기 결합을 분해하기 위해 많은 에너지를 요구하지만 분해가 시작되면서 작은 에너지로도 반응을 유지할 수 있음을 의미한다. Stage 2의 활성화에너지는 전체 반응에 대해 약 200-215 kJ/mol로 나타났다. 폴리올의 분해 과정은 전환도에 따라 요구되는 에너지 변화가 크게 나타나지 않는데, 이는 stage 1에 비해 안정적으로 분해될 수 있는 것으로 보인다. 또한, Kissinger 법의 활성화에너지와 FWO, KAS, Starink 법의 활성화에너지를 정량적으로 비교하였다. FWO 법의 경우, stage 1에 대해 약 8-20.5%, stage 2에 대해 0.05-3.8%의 차이가 발생한다. KAS 법의 경우, stage 1에 대해 약 8.4-21.6%, stage 2에 대해 0.02-4.1%의 차이가 발생한다. Starink 법의 경우, stage 1에 대해 약 7.3-20.7%, stage 2에 대해 0.09-5.3%의 차이가 발생한다. 전환도를 고려한 반응 메커니즘으로부터 활성화에너지를 산출하게 되면 열분해 반응에 따른 변화된 값을 반영할 수 있다. 이에 본 연구에서는 폴리우레탄 폼의 활성화에너지를 산출할 때 Kissinger 법은 제외하고 FWO, KAS, Starink 법을 사용하였다.
ICTAC에 따르면, 최대·최소 활성화에너지 값의 차이와 평균값과 비교하였을 때, 그 차이가 20-30% 미만이라면 전환도를 고려하지 않는다고 알려져 있다[9]. Table 5에 3가지 방법론에서 산출된 최대·최소 활성화에너지와 평균값과 차이를 나타내었다. 따라서 FWO, KAS, Starink 법에서 산출된 활성화에너지는 각각 평균값을 적용할 수 있다. 또한, 3가지 방법론의 평균값을 비교하였을 때 큰 차이가 없다. 따라서, 3가지 방법론의 평균값을 평균하여 최종적으로 폴리우레탄 폼의 활성화에너지를 산출하였다. 최종적으로 산출된 활성화에너지는 stage 1에 대해 211.123 kJ/mol, stage 2에 대해 210.649 kJ/mol이다. 즉, 폴리우레탄 폼이 폴리올과 기체상의 이소시아네이트로 분해되는 우레탄 결합을 끊기 위해 필요한 최소 에너지는 약 211.1 kJ/mol이며, 폴리올이 분해되기 위해 필요한 최소 에너지는 약 210.6 kJ/mol이다.
Table 5.
Maximum, minimum, and average activation energies for FWO, KAS, Starink methods
3.2.2 반응 메커니즘
Model-free 법의 활성화에너지를 기반으로 model-fitting 법의 평균 활성화에너지와 비교하여 반응 메커니즘을 결정하였다. Table 3에 제시된 여러 반응 메커니즘 중, stage 1은 g(α)=α2, stage 2는 g(α)=(1-α)-1-1의 평균 활성화에너지가 각각 9.6%, 20.9%로 가장 작은 오차를 보였다. 따라서, 폴리우레탄 폼의 열분해 과정은 stage 1은 g(α)=α2, stage 2는 g(α)=(1-α)-1-1로 가장 유사하게 표현할 수 있다. Table 6에 선정된 반응 메커니즘과 각 승온속도에서의 활성화에너지 및 평균 활성화에너지가 제시되어 있다. Table 7에 반응 메커니즘의 승온속도에 대한 활성화에너지를 기반으로 계산된 stage 1과 stage 2의 선인자 계수를 나타내었다.
Table 6.
Reaction mechanisms and activation energies of polyurethane foam determined from model- fitting method
| Stage | Heating rate (°C/min) | Reaction mechanism |
Activation energy (kJ/mol) | |
| Value | Average | |||
| 1 | 5 | 241.971 | 231.379 | |
| 10 | 232.252 | |||
| 15 | 232.36 | |||
| 20 | 218.932 | |||
| 2 | 5 | 165.654 | 166.687 | |
| 10 | 162.678 | |||
| 15 | 173.611 | |||
| 20 | 164.806 | |||
Table 7.
Pre-exponential factors for the reaction mechanism at various heating rates
| Stage | Heating rate (°C/min) | Pre-exponential factor (s-1) |
| 1 | 5 | 8.83E+16 |
| 10 | 9.10E+15 | |
| 15 | 8.13E+15 | |
| 20 | 4.38E+14 | |
| 2 | 5 | 4.40E+08 |
| 10 | 2.87E+08 | |
| 15 | 2.43E+09 | |
| 20 | 5.08E+08 |
3.2.3 반응속도론적 보상 효과 기반 선인자 계수
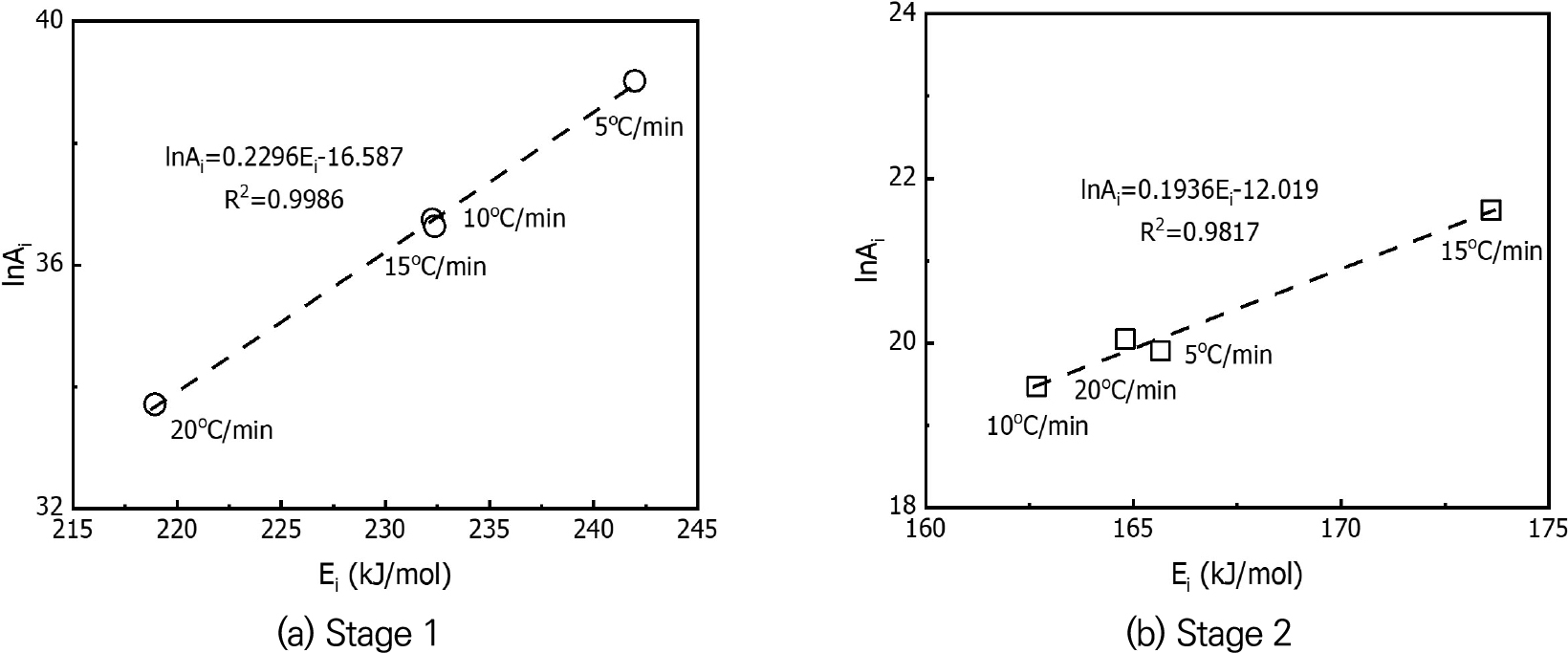
Fig. 5는 model-fitting 법을 통해 결정된 각각의 5, 10, 15, 20°C/min 승온속도에서 활성화에너지와 선인자 계수의 자연로그 값의 관계를 나타낸 것이다. 선형적인 관계를 의미하는 상관계수는 stage 1과 stage 2에 대해 각각 0.9986, 0.9817로서 1에 가까운 값이므로, 보상 계수를 결정할 수 있다. Stage 1의 보상 계수 a와 b는 각각 0.2296, -16.587이며, 식 (11)은 식 (12)과 같이 나타낼 수 있다.
Stage 2의 보상 계수 a와 b는 각각 0.1936, -12.019이며, 식 (11)은 식 (13)과 같이 표현된다.
식 (12) 및 식 (13)의 E0에 각각 211.123 kJ/mol, 210.649 kJ/mol을 대입하여 선인자 계수를 유도하였다. 폴리우레탄 폼의 반응속도론적 변수인 선인자 계수는 stage 1에 대해 7.05E+13 s-1, stage 2에 대해 3.1E+12 s-1이다.
3.3 열분해 반응 모델링
본 연구에서는 화재 시뮬레이션인 FDS를 사용하여 열분해 반응을 모델링 하였다. 열분해 모델링 시 요구되는 변수인 열적 물성값은 Table 8, 열분해 물성값은 Table 9에 나타내었다. 폼의 성분으로 구성된 stage 1의 열적 물성값은 Hot disk 법으로 측정되었고, 폴리올의 성분으로 구성된 stage 2의 열적 물성값은 기존 문헌에서 참고했다[29]. 열분해 물성값은 본 실험으로부터 유도되었다.
Table 8.
Thermal properties of polyurethane foam used pyrolysis modeling
| Stage |
Density (kg/m3) |
Thermal conductivity (W/m·K) | Specific heat (kJ/kg·K) |
| 1 | 24.45 | 0.0478 | 2.27 |
| 2 | 800 | 0.085 | 2.4 |
Table 9.
Pyrolysis kinetic properties of polyurethane foam used pyrolysis modeling
| Stage |
Activation energy (kJ/mol) | Pre-exponential factor (s-1) |
| 1 | 211.123 | 7.05E+13 |
| 2 | 210.649 | 3.1E+12 |
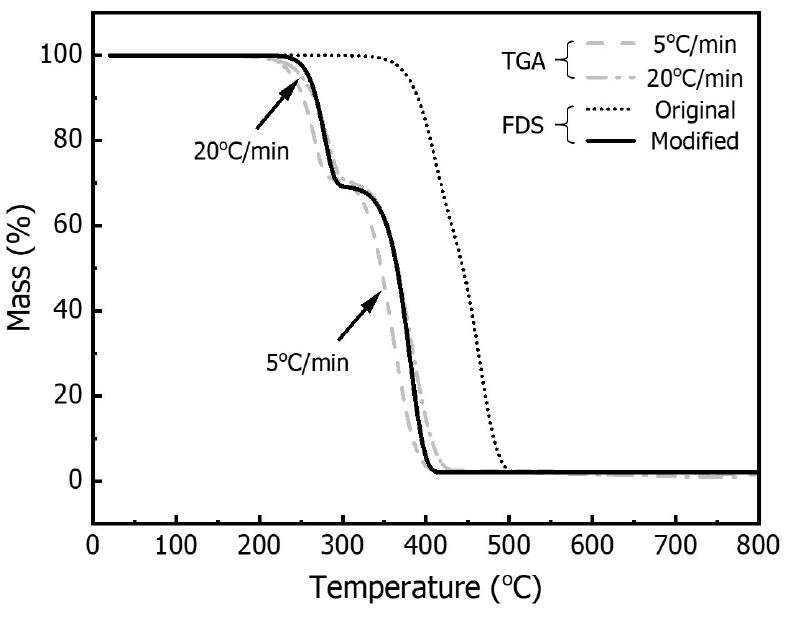
Fig. 6은 TGA 실험 결과와 시뮬레이션 예측 결과를 비교하여 나타낸 것이다. 실험에서 승온속도가 증가함에 따라 곡선이 오른쪽으로 이동하였으므로, 최소(5°C/min) 및 최대(20°C/min) 승온속도에서의 결과를 표시하였다. 실험에서 유도된 활성화에너지와 선인자 계수를 적용하여 시뮬레이션을 수행한 경우(Original), 실험보다 열분해 반응속도가 과소 예측되었다. 열분해 반응속도를 빠르게 예측하기 위해 선인자 계수 값을 수정하였고, Table 10에 제시하였다. 선인자 계수만을 수정하여 시뮬레이션을 수행한 경우(Modified), 실험 결과 범위 내에 존재하였다. 또한, 폴리우레탄 폼의 두 가지 성분이 열분해를 통해 반응하는 두 번의 뚜렷한 질량 감소를 예측하였다. 이를 통해 FDS에서 폴리우레탄 폼 열분해 모델링 시, 고체 표면에서 가연성 기체가 생성되는 반응속도를 예측하기 위한 열분해 물성값을 도출하였다.
열분해 모델을 활용하여 연소 및 화재를 예측할 때 실험에서 유도된 값을 바로 적용한다면, 시뮬레이션이 결과를 과대 또는 과소 예측할 수 있다. 따라서, 연소 반응을 정확하게 해석하기 위해서는 열분해 물성값에 대한 검토가 이루어져야 한다. 또한, FDS에서 열분해 모델링을 통한 열분해 과정이 화재 현상을 구현하는 데 미치는 영향을 검토하기 위해 기체 반응 해석 등 추가적인 연구가 필요하다.
4. 결 론
본 연구에서는 질소 대기 조건에서 열중량 분석을 수행하여 폴리우레탄 폼의 열분해 반응을 조사하였다. 반응속도론적 분석을 통해 활성화에너지, 선인자 계수와 반응 메커니즘을 도출하였다. 화재 시뮬레이션의 열분해 모델을 활용하여 열분해 과정을 예측하였다.
폴리우레탄 폼은 두 가지 성분이 반응하여 생성되는 물질로서 열에 노출되면 두 번의 뚜렷한 질량 감소가 나타났다. 이에 본 연구에서는 폴리우레탄 폼의 두 단계 반응 각각에 대해 해석하였다. 열중량 분석 실험 결과를 기반으로 반응속도론적 변수를 산출하였다. 선인자 계수는 model- free 법을 사용하여 계산하기 어려워 반응 메커니즘이 요구된다. 이에 반응 메커니즘을 도출하고, 반응 메커니즘을 기반으로 보상 효과를 적용하기 위해 model-free 법과 model-fitting 법이 동시에 고려되었다. 실험에서 유도된 반응속도론적 변수를 화재 시뮬레이션 열분해 모델의 입력 변수로서 적용하였다. 열분해 모델이 폴리우레탄 폼의 2단계 열분해 반응을 예측할 수 있었다. 예측된 열분해 반응속도를 기반으로 화재 현상을 구현할 때 미치는 영향에 대한 검토가 필요하다.
기 호 설 명
TGA : Thermogravimetric analysis
FDS : Fire dynamics simulator
ICTAC : International Confederation for Thermal Analysis and Calorimetry
NIST : National Institute of Standards and Technology
TG : Thermogravimetric
DTG : Derivative thermogravimetric
r : Reaction rate (s-1)
α : Extent of conversion
t : Time
k(T) : Reaction rate constant
f(α) : Reaction function for extent of conversion
ms : Sample mass at start point
mt : Sample mass at measure point
mf : Sample mass at end point
A : Pre-exponential factor (s-1)
Ea : Activation energy (kJ/mol)
R : Gas constant (J/molK)
FWO : Flynn-Ozawa-Wall
KAS : Kissinger-Akahira-Sunose
β : Heating rate (°C/min)
T : Surface temperature (K)
Tp : Peak temperature (°C)
Tα : Temperature at the extent of conversion (°C)
g(α) : Integral reaction function for extent of conversion
CR : Coats-Redfern
Ei : Activation energy of model-fitting method (kJ/mol)
Ai : Pre-exponential factor of model-fitting method (s-1)
a, b : compensation effect parameter
E0 : Activation energy of model-free method (kJ/mol)
A0 : Pre-exponential factor of model-free method (s-1)
CFD : Computational fluid dynamic
ρs : Density of solid (kg/m3)
n : Reaction order