1. 서 론
2. 수치 해석 방법
3. 결과 및 논의
3.1 CO-O2 화염의 H2O 첨가 효과
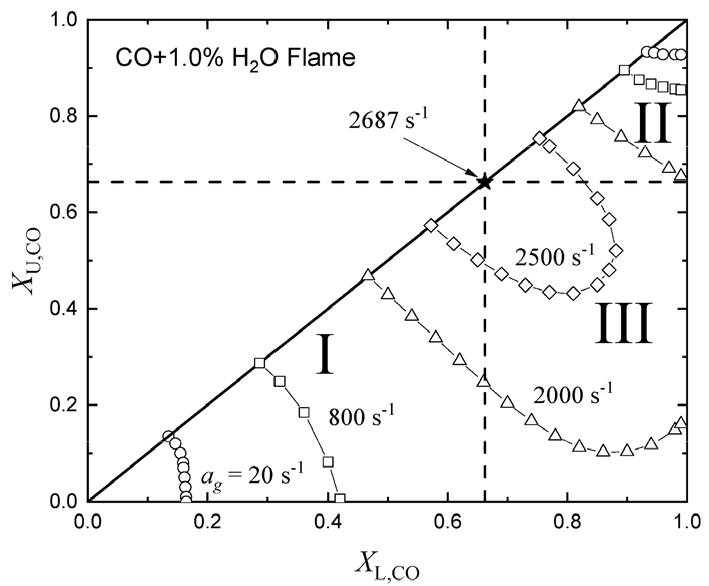
3.2 후류 상호작용하는 CO-O2와 (CO + 1% H2O)-O2 예혼합화염의 안정화 선도 비교
3.3 CO-O2 화염의 상호작용
3.4 (1% H2O + CO)-O2 화염의 상혹작용
4. 결 론
1. 서 론
대향류 화염의 기초 화염 특성은 화학 반응 모델과 층류 소화염편(laminar flamelet) 난류화염 모델링의 개발에 있어서 중요한 도구로 사용된다. 층류소화편 모델 개발에 있어서 화염간의 상호작용은 여전히 난제에 해당하지만 1980년대 후류 상호 작용의 연구로 동종 연료인 메탄과 프로판 화염들의 열적 상호작용(thermal interaction)을 통해 중요한 특성들을 보고되었다[1,2,3,4]. 즉, Lewis 수(Le)가 1보다 작은 경우 열적 상호 작용이 크고, 반대로 Le > 1 인 경우 열적 상호작용이 작다는 것을 보였다. Le < 1 인 경우 화염 안정화 선도의 화염 소화 경계선이 기울어지는 형태를 가지며, Le > 1인 경우는 화염 소화 경계선이 사각형 형태를 나타낸다는 것을 보인 바 있다[4]. 즉, 화염 안정화 선도에 나타나는 화염 소화 경계선의 형태를 조사하는 것만으로도 개략적인 화염 간의 후류 상호 작용 정도를 추측할 수 있었다. 이후로 화염 간의 후류 상호 작용에 대한 연구는 스트레인율의 효과, 이종 연료 간의 화염 상호 작용, CO2 첨가에 의한 화학적 효과, 차등 확산(differential diffusion) 효과 등에 대해 다양한 혼합 연료들의 경우로 확장 연구되었다[5,6,7,8,9,10,11,12].
일산화탄소 화염은 수소 화염과 더불어 탄화 수소 연료의 근간이 되는 화학 반응 기구에 해당한다. 그럼에도 불구하고 매우 긴 화학 반응 시간으로 인해 일산화 화염 연소 자체에 대한 연구는 거의 존재하지 않으며 단순히 화학반응 억제자(inhibitor)로서 역할로서 사용되거나 타 연료를 첨가하여 화학반응시간을 감소시키는 연료로써 활용되었다[13,14]. 이러한 특성들은 H2/CO 합성가스 예혼합 화염들 간의 후류 상호 작용에서도 잘 나타난다[7,8,10]. 순수 일산화 탄소 화염의 경우 산화 반응은 CO + 0.5O2 → CO2을 통해 이루어지며 이러한 반응의 화학반응시간은 매우 길다. 따라서 매우 작은 양의 수소가 첨가되는 경우 H, O, OH 라디칼이 생성되어 CO의 산화 반응 경로는 화학 반응 시간이 훨씬 짧은 CO + OH → CO2 + H로 바뀌면서 이러한 화학 반응에 의해 연소 특성이 완전히 달라진다. 이러한 특성은 수소-공기와 일산화탄소-공기 예혼합 화염 간의 후류 상호작용에서 잘 나타나는데 가연한계 영역 범위 밖의 수소-공기 화염의 일산화탄소 화염과 상호작용하는 경우 수소가 단독으로 연소하는 것이 불가능하지만, 일산화탄소-공기 화염에 기생하여 H, O, OH의 라디칼을 공유하면서 일산화탄소 화염의 특성에 영향을 미치는 것을 확인한바 있다[9,10].
소량의 H2O가 연료 희석제로 사용되는 경우 주로 H2O + O → OH + OH의 반응을 통해 OH 라디칼을 생성하고 급격한 라디칼 연쇄 반응을 통해 연료의 전체 반응율 지표에 해당하는 H + O2 → O + OH 반응율을 높이는 반응 촉진자로서 역할을 하게 되고, H2O의 양이 점차 증가함에 따라 반응 촉진자로서의 역할에 비해 연료에 대한 희석제로서의 역할이 커짐에 따라 전체 화학 반응율은 오히려 감소하게 된다[15]. 따라서 일산화탄소 화염에 H2O가 혼합되는 경우에도 이러한 특성이 기대되지만 이러한 연구는 문헌 상에 보고된 바 없다.
본 연구에서는 일산화탄소-산소 예혼합기의 화염 후류 상호작용에 대한 연구에 있어서 1%의 H2O가 연료측에 첨가되는 효과에 관한 연구를 수행하고자 한다. 후류 상호작용하는 일산화탄소-산소 예혼합화염의 안정화 선도와 화염 구조를 조사하고 연료측에 1%의 H2O를 첨가한 경우, 화염 안정화 선도 및 화염 구조의 변화를 조사함으로써 화염 후류 상호작용에 있어서 미량의 H2O 첨가 효과를 보고하고자 한다.
2. 수치 해석 방법
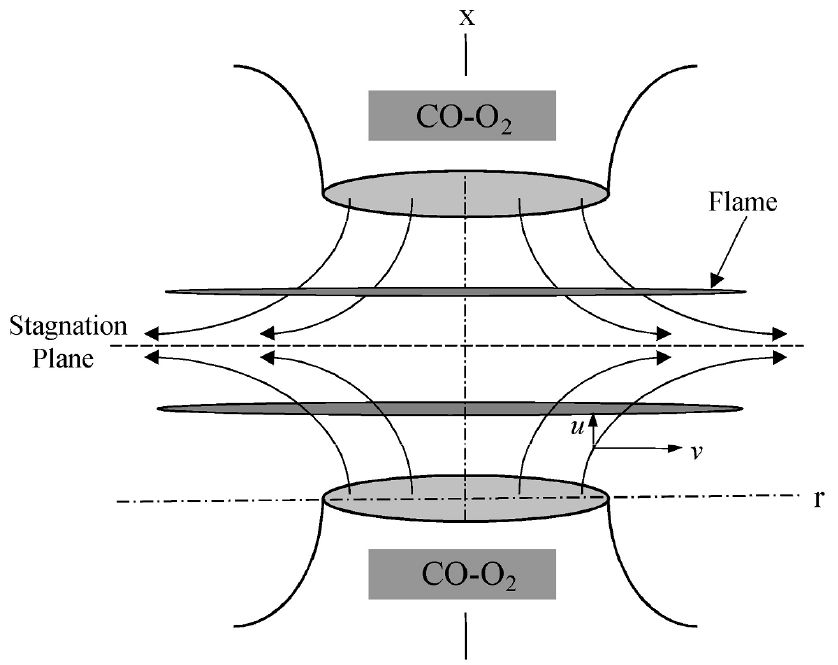
Fig. 1에 후류 상호작용하는 CO-O2 대향류 예혼합 화염의 개략도를 나타내었다. 정체점 근처에서 유효한 상사변수에 의해 1차원 화염 구조를 갖는 상미분 지배방정식은 Kee 등[16]에 의해 개발되었고, Lutz 등에 의해 Oppdif Code[17]에 의해 잘 알려져 있기 때문에 상세한 지배 방정식과 해법은 여기서는 생략한다. 전체 화염 신장율은 로 정의하였고, 은 노즐 출구 속도와 버너간 거리이고 하첨자 은 각각 상부 및 하부 노즐을 의미한다. 여기서 버너 사이의 거리는 20 mm로 고정하였다. 복사 열손실을 고려하는 경우 CO-O2 화염에 있어서 초기해를 얻는 어려움과 화염 안정화 영역이 극단적으로 좁아지는 문제가 있고, 실제로 타연료의 경우 광학적 박 모델(optical thin model)[18] 사용한 경우 스트레인율이 작은 경우에도 복사 열손실 효과는 무시할 정도였기 때문에 본 연구에서는 복사 열손실 효과는 무시하였다. 이러한 지배 방정식은 Chemkin 코드[19]와 Tranfit 코드[20]를 사용하여 해를 구하였다.
수치해석은 1기압, 300 K에서 화학종과 온도에 대해 Dirichlet 경계조건을 사용하였다. Grid와 Curv는 각각 0.05와 1을 사용하여 각 그리드는 0.1 mm 두께에 해당하는 화염 두께에 비해 훨씬 작았다. 하단 버너의 연료 농도를 고정하고 상단 버너의 연료 농도를 변화시키면서 수렴하던 해가 발산하는 경우의 연료 농도 조건을 화염 소화 한계로 정의하는 방법과 호길이 연속 계산법(arclength continuation method)에 의해 화염 소화를 구하는 경우에 있어서 일반적으로 연료 농도에 있어서 그 에러가 0.5% 이하로 무시할 정도로 작기 때문에 현재의 경우는 전자의 경우를 채택하였다[6,7,8,9,10,11,12]. CO 화염에 대해서는 문헌 상에서 실험 데이터가 존재하지 않기 때문에 H2/CO 합성가스의 전체 혼합 비에 대해서 층류화염전파속도와 점화지연시간 등을 잘 예측할 수 있는 Davis 모델[21]을 화학 반응 기구로 채택하였다. CO-O2 예혼합기에 의해 나타나는 후류 상호작용하는 화염에 대해 연료 측에 1% H2O를 첨가하여 H2O 첨가 효과에 초점을 맞추어 연구를 수행하였다.
3. 결과 및 논의
3.1 CO-O2 화염의 H2O 첨가 효과
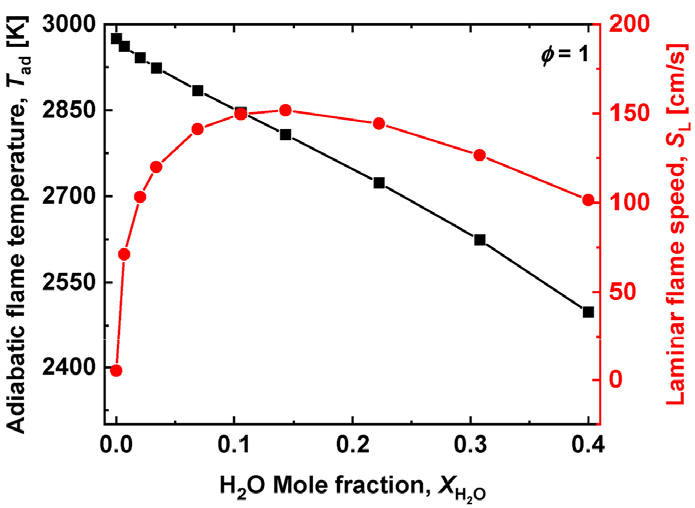
H2O를 연료 측에 첨가하는 경우의 단열화염온도와 층류화염전파속도를 Fig. 2에 나타내었다. 단열화염온도 는 로 표현된다. 여기서 는 미연측 온도, 는 미연측 연료 질량분율, 는 열방출율을 나타낸다. 단열화염온도는 화학반응에 대한 정보를 포함하고 있지 않기 때문에 Fig. 2에 나타나듯이 연료측에 H2O 첨가함에 따라 단열화염온도는 단조 감소한다. 층류 화염 전파속도 은 로 표현되며, 여기서 는 혼합기의 열전도도, 는 반응율, 는 Zeldovich 수이다. 층류 화염 전파속도는 위의 식으로부터 알 수 있듯이 화학 반응에 대한 정보를 포함하고 있다. 결국 CO-O2 예혼합 화염에 1% H2O를 첨가하여도 CO + 0.5O2 → CO2 반응으로부터 산화반응 경로가 CO + OH → CO2+H로 바뀌면서 층류 화염전파속도는 5.3 cm/s로부터 1% H2O 첨가에 대해 81.8 cm/s 그리고 15% H2O 첨가에서 151.7 cm/s까지 급격히 증가하여 화염 안정성을 급격히 증가시키게 된다. 이후로 15% 이상 H2O를 첨가하면 희석 효과에 의해 화염전파속도는 감소하게 된다. Fig. 2에 나타난 바와 같이 화염전파속도는 가 증가함에 따라 급격히 증가하다가 서서히 감소한다는 것을 알 수 있다. 이것은 H2O가 미량 첨가되는 경우 H2O + O → OH + OH의 반응을 통해 OH 라디칼을 생성하고 급격한 H, O, OH 라디칼 생성으로 전체 반응율의 지표인 H + O2 → O + OH이 증가함은 물론 CO의 주 산화반응 경로가 특성 화학반응시간이 매우 긴 CO + 0.5O2 → CO2로부터 특성화학반응시간이 작은 CO + OH → CO2 + H로 바뀌면서 화학반응율을 증진한다는 것을 의미한다. 그러나 H2O 첨가가 과다하면 이러한 화학적 효과보다는 희석제의 증가로 인한 화학반응율의 감소 효과가 더 우세해진다는 것을 의미한다.
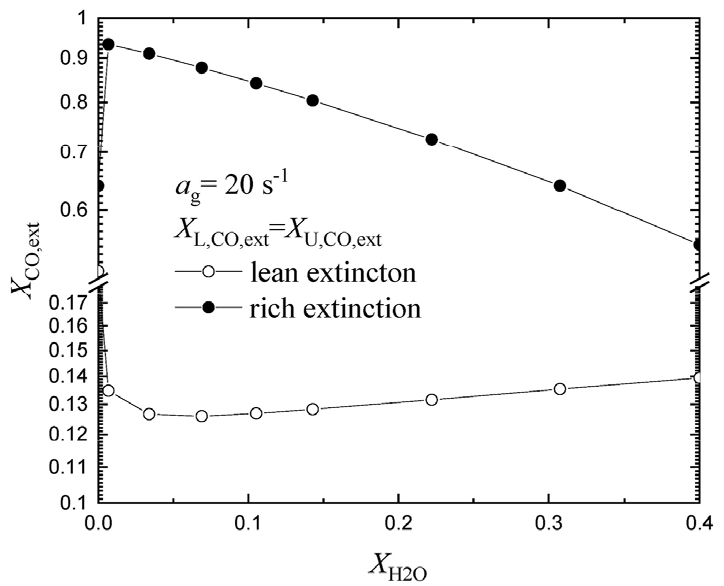
이러한 효과들이 현재 연구 대상인 후류 상호 작용에 어떠한 영향을 미치는지 확인하기 위해 쌍둥이 화염 조건 ()에서 전체 화염 신장율 이 20 s-1인 경우에 대해 희박 및 과농 화염 소화 조건에서의 CO 몰분율 을 H2O 첨가에 따라 Fig. 3에 나타내었다. CO-O2 화염으로부터 () 1% H2O 첨가에 해당하는 에 대해서 희박 및 과농 쌍둥이 화염의 소화 조건이 급격히 확장되는 것을 알 수 있다. 희박 조건에서는 15% H2O 첨가 ()까지 CO 몰분율 이 확장되며 과농 조건에서는 1% 이상 H2O를 첨가하며 다시 이 감소하는 것을 알 수 있다. 결과적으로 첨가되는 H2O가 화학적 효과가 우세한 영역과 희석 효과가 우세한 영역으로 나눌 수 있다는 것을 알 수 있다. 본 연구에서는 희석 효과에 대해서는 타 연료에서도 예견될 수 있으므로 본 연구에서는 첨가되는 H2O의 화학적 효과적 효과에 집중하기 위해 1% H2O 첨가가 후류 상호 작용에 있어서 화학적 상호작용을 통해 화염 특성을 변화시키는지에 초점을 맞추어 연구를 수행하고자 한다.
3.2 후류 상호작용하는 CO-O2와 (CO + 1% H2O)-O2 예혼합화염의 안정화 선도 비교
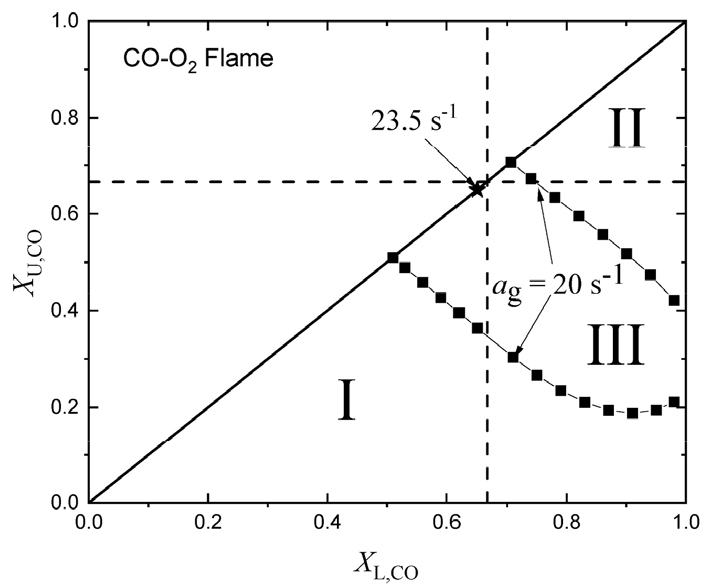
Figs. 4와 5는 후류 상호작용하는 CO-O2와 (CO + 1% H2O)-O2 예혼합화염의 안정화 선도를 각각 나타낸다. 그림에서 파선의 수직선과 수평선은 당량 혼합 조건을 나타내며, CO-O2 화염에 대해서는 (XL,CO, XU,CO) = (0.6667, 0.6667)이고 (0.1% H2O + CO)-O2 화염에 대해서는 (0.6622, 0.6622)이다. 그림에서 I은 희박-희박 화염 간의 상호작용하는 영역이고, II는 과농-과농 화염 간의 상호작용을 하는 영역, 그리고 III는 과농화염, 희박화염 그리고 확산화염의 삼중 화염이 형성되어 상호작용을 하는 영역을 나타낸다. CO-O2 화염의 경우 20 s-1만 되어도 화염 안정화 영역이 매우 좁아진 것을 알 수 있고, 화염신장율이 23.5 s-1만 되어도 모든 화염은 모든 조건에서 화염이 소화된다는 것을 알 수 있다. 한편 연료 측에 1% H2O를 첨가한 경우 Fig. 5에 보여진 바와 같이 화염 안정화 영역이 급격히 확장된 것을 알 수 있다. 한편 열적 상호작용은 수소, 메탄, 프로판, 부탄 등 단일 연료에 대해 연료 루이스수 (LeF, fuel Lewis number)에 의해 영향을 받는 것이 알려져 있다. 즉, LeF > 1인 경우 열적 상호작용은 약하고, LeF < 1인 경우 열적 상호작용은 강한 것으로 알려져 있다[4]. 현재의 CO 화염에 대해 LeF는 CO-O2 화염에 대해서는 1.025 < LeF < 1.052 그리고 (0.1% H2O + CO)-O2 화염에 대해서는 1.072 < LeF < 1.119의 범위에 해당한다. 한편 유효 루이스수 Leeff는 Leeff = (LeF +AFLeO)/(1+AF)로 나타낼 수 있다. 여기서 LeO는 산화제 루이스수, , 그리고 는 연료에 대한 산화제의 질량비이다. 유효 루이스수로 표현한 경우 CO-O2 화염에 대해 Leeff는 1.040 < Leeff < 1.053 그리고 (0.1% H2O + CO)-O2 화염에 대해 1.042 < Leeff < 1.073에 해당한다. 결과적으로 CO-O2와 (0.1% H2O + CO)-O2 화염들은 루이스수를 통한 열적 상호 작용은 약하다는 것을 알 수 있다.
CO-O2 화염의 경우 20 s-1인 경우 화염 소화 경계선이 기울어져 있는데 이것은 루이스수들이 1보다 크다는 것을 고려할 때 열적 상호작용이 아닌 화학적 상호작용에 의해 나타난 것이므로 뒤에서 설명할 것이다. (0.1% H2O + CO)-O2 화염의 화염신장율이 20 s-1인 경우 화염 소화의 희박 및 과농 소화 경계선이 거의 사각형의 형태를 나타내는 것은 반응대의 두께 𝛿가 에 관련 되므로 화염 신장율이 작은 경우 화염 간의 거리가 상대적으로 커서 화학적 상호작용 역시 작다는 것을 의미한다. 후류 상호작용하는 화염에 있어서는 화염 신장율이 증가하면 화염 안정화 영역이 감소하는 것은 기존 연구 결과들과 일치한다[5,6,7,8,9,10,11,12]. 화염 신장율이 증가하여 2500 s-1이 되면 화염 안정화 영역은 섬 형태를 나타내며 더 증가하여 2687 s-1이 되면 당량비 1인 경우를 제외하고는 모든 화염 조건에서 화염이 소화된다. 한편, 기존 연구에서 임계 화염신장율에서 모든 화염이 소화되는 조건은 H2/CO 합성가스를 포함하여 모든 연료들에 대해서 당량비가 1보다 약간 작은 경우에서 발생하였고, 이것은 Fig. 4에 보인 바와 같이 CO-O2 화염에서도 동일한 특성이 나타난다[5,6,7,8,9,10,11,12]. Fig. 5에 나타낸 바와 같이 (0.1% H2O + CO)-O2 화염의 경우는 임계 화염신장율이 당량비 1에서 나타나는 것을 볼 수 있는데 이것은 확장 연구를 통하여 미래에 밝혀져야 할 문제로 남아있다.
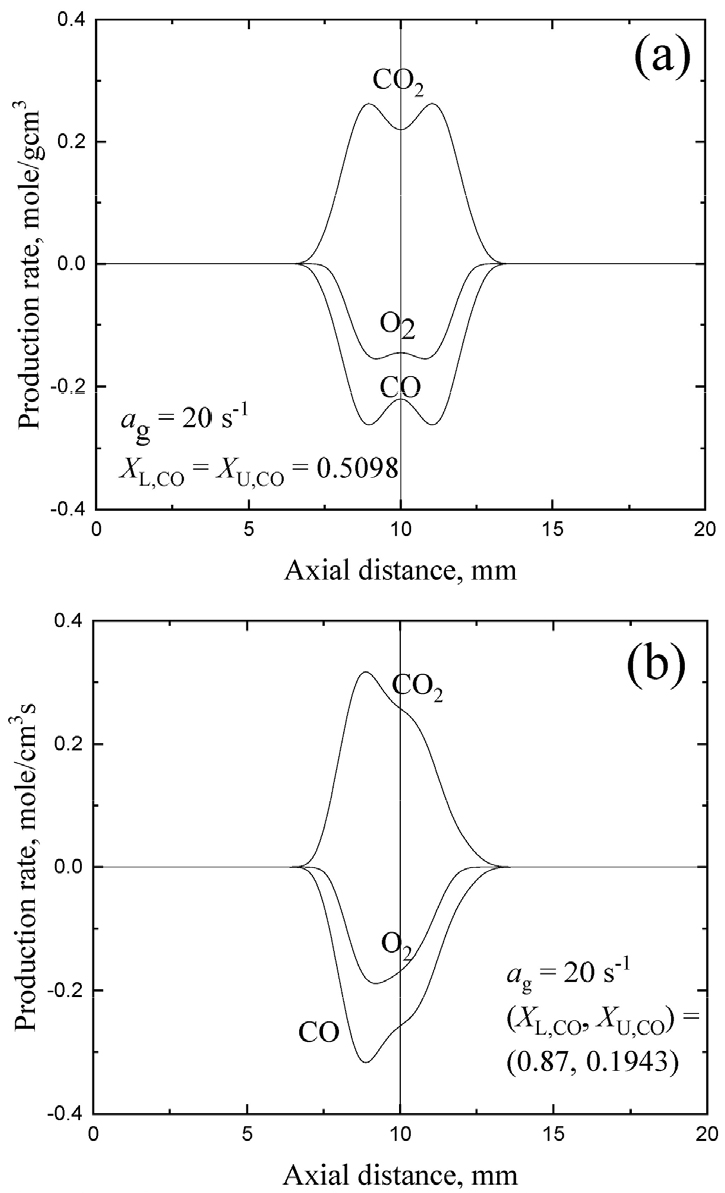
3.3 CO-O2 화염의 상호작용
Fig. 6은 인 경우에 소화 경계선위에 있는 상호작용하는 CO-O2 화염들에서 화학종 생성율의 공간 분포를 (XL,CO, XU,CO) = (0.5098, 0.5098)와 (0.87, 0.1943)에 대해 나타내었다. (a)는 쌍둥이 (희박-희박) 화염 간의 상호 작용을 나타내며 (b)는 과농-희박 예혼합기로부터 과농화염, 희박화염, 확산화염으로 구성된 삼중화염(triple flame) 간의 화염 상호 작용을 나타낸다. (과농-과농) 쌍둥이 화염에 대해서도 유사한 분포를 나타내기 때문에 여기서는 제시하지 않는다. Fig. 6에서 수직 실선은 유동 정체점의 위치를 나타낸다.
희박 쌍둥이 화염의 경우 전형적인 이중 정점 형태의 CO와 O2 소모율을 가지며 이중 정점의 CO2 생성율을 갖는 점으로부터 두 화염간의 화학적 상호 작용이 강하지 않다는 것을 알 수 있다. 삼중 화염 조건에서는 강한 화염이 하부 버너 측에 존재하고 확산화염과 희박화염이 구분되지 않는 점으로부터 단독으로 생존하기 어려운 희박화염이 확산화염에 합체되어 (merging) 과농 화염과 상호 작용을 한다는 것을 알 수 있다. Fig. 4에서 CO-O2 화염의 경우 소화경계선이 사선의 형태를 갖는 이유는 루이스수가 1보다 커서 열적 상호작용은 작고 화염 신장율이 작아서 화염 간의 거리가 크지만 스스로 화염으로 존재하기 어려운 약한 화염이 확산 화염과의 합체를 통해 O2를 공유함으로써 생존하기 때문이며 결과적으로 이러한 화학적 공생을 통한 생존 방식을 취하기 때문이다. 결과적으로 약한 화염이 강한 화염 혹은 삼중화염의 경우는 약한 화염이 확산화염에 합체되어 합체된 지점의 당량비를 조절하면서 생존하는 방식을 취하기 때문에 나타나는 현상에 기인한다.
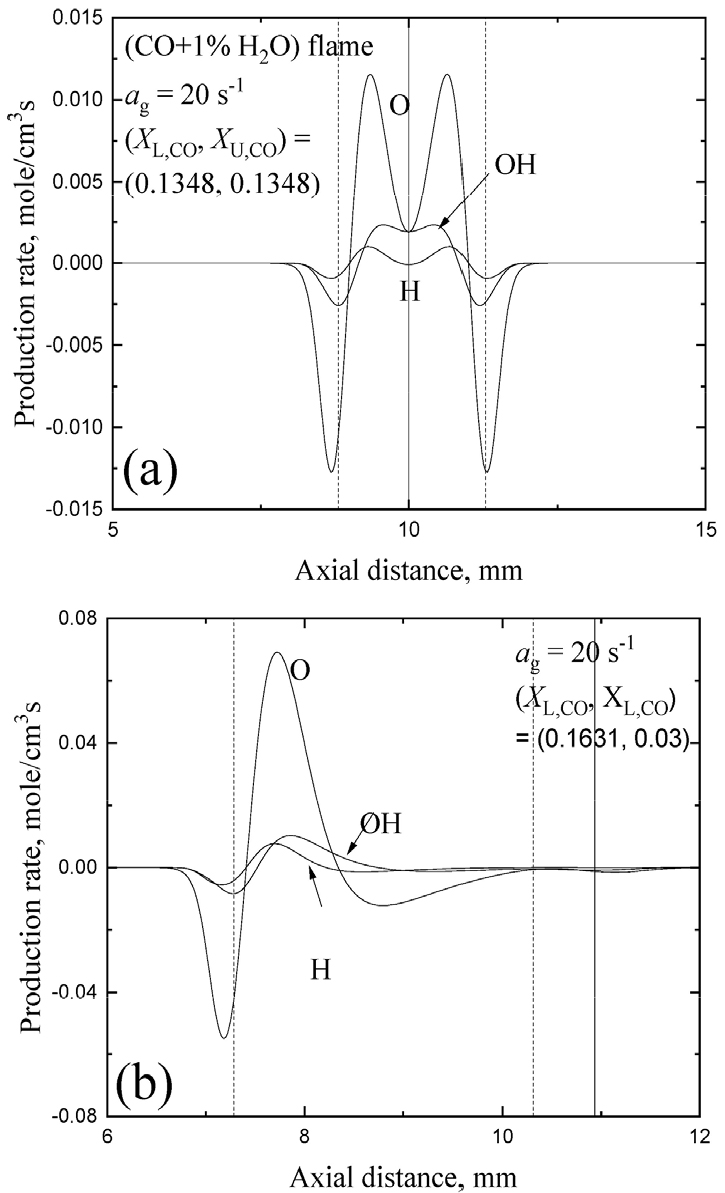
3.4 (1% H2O + CO)-O2 화염의 상혹작용
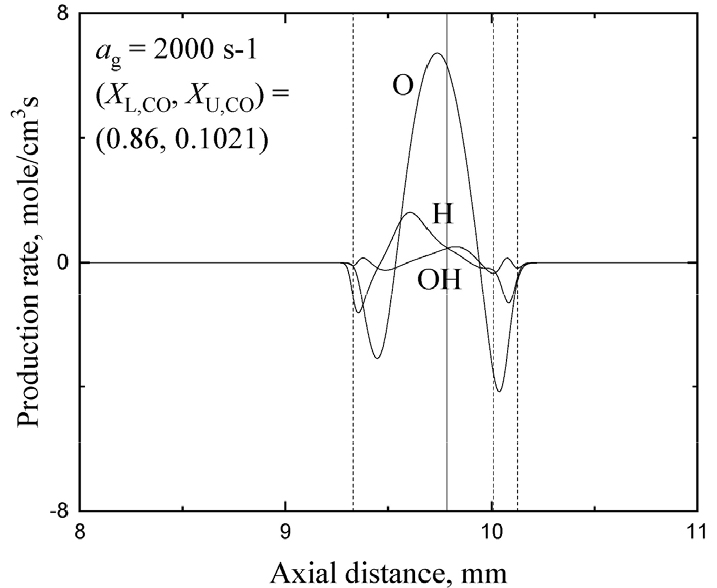
Figs. 7과 8은 인 경우에 소화 경계선위에 있는 상호작용하는 (1% H2O + CO)-O2 화염들에서 화학종 생성율의 공간 분포를 (XL,CO, XU,CO) = (0.1348, 0.1348)과 (0.1631, 0.03) 그리고 (0.9331, 09331)과 (0.98, 0.9274)에 대해 나타내었다. 여기서 파선의 수직선과 수평선은 OH 소모율이 최대인 지점으로 정의된 화염 위치들을 나타내고 수직 실선은 유동 정체점의 위치를 나타낸다. 쌍둥이 화염 조건들에 대해서는 두 경우 모두 H, O, OH 라디칼들의 공유를 통한 화염 간의 상호 작용이 크지 않음을 알 수 있다. 흥미롭게도 희박 조건에서는 O의 소모율과 생성율이 가장 크고 과농 조건에서는 H의 소모율과 생성율이 크다는 것을 알 수 있다. 즉, 전자는 H2O + O → OH + OH 반응을 통해 OH를 활발히 생성하고 이것이 CO + OH → CO2 + H 반응율 증가에 크게 기여하게 된다. 반면 후자의 경우는 H2O + H → OH + H2 반응을 통해 OH를 상대적으로 덜 생성하기 때문에 CO + OH → CO2 + H 반응율은 그리 크지 못함을 예측할 수 있고 이러한 특성은 Figs. 7a와 8a로부터 확인된다. 결국 쌍둥이 희박-희박 화염들의 화염 강도들이 쌍둥이 과농-과농 화염들에 비해 더 크다는 것을 알 수 있다. Fig. 7b의 강한 희박화염과 약한 희박화염 간의 상호작용을 살펴보면 두 화염 들간의 거리가 비교적 멀리 떨어져 있음에도 불구하고 강한 화염으로부터 생성된 O가 약한 화염과 공유하면서 소모되어 OH를 생성하고 OH 소모를 통하여 약한 화염을 생존시키고 있음을 볼 수 있다. 이러한 경우 약한 화염 측에서 정체점을 넘어가서 OH 라디칼을 공유하면서 OH 소모는 크지는 않지만 CO + OH → CO2 + H 반응을 통해 간신히 생존하는 구조를 갖는다는 것을 알 수 있다. Fig. 8b의 강한 과농화염과 약한 과농화염을 살펴보면 약한 화염이 정체점을 넘지는 않지만 정체점 근처까지 이동하여 H를 공유하면서 매우 적은 OH를 생성하고 강한 화염으로부터 OH를 공유하면서 CO + OH → CO2 + H 반응을 통해 약한 화염이 생존하는 구조임을 알 수 있다. 여기서는 제시되지 않지만 화염 신장율이 2000 s-1로 증가하여 화염 간의 거리가 작아지면 이러한 화학적 상호작용 효과들은 더욱 명백히 나타나지만 여기서는 따로 결과들을 제시하지는 않는다.
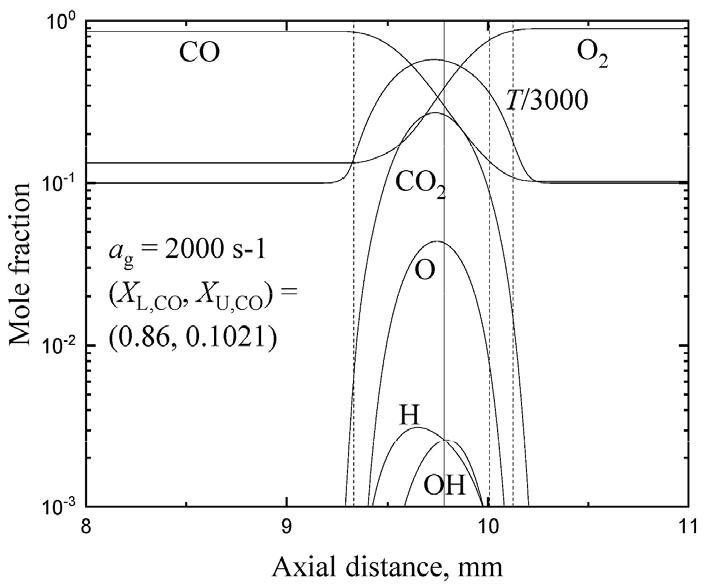
Fig. 9는 화염 신장율 2000 s-1에서 삼중화염 경우에 대한 화염 구조를 나타내었다. Fig. 10은 같은 경우에 대해 각 화학종의 생성율을 나타낸다. Fig. 9에 잘 나타나 있지만 하단 버너 측에 과농 화염, 상단 버너 측에 희박 화염 그리고 그 사이에 확산 화염의 전형적인 삼중 화염의 구조를 나타내고 있다. 과농측에서 소모되지 못한 연료와 희박 연료로부터 소모되지 않은 O2가 만나 확산화염을 형성하여 화염 강도가 약한 희박 화염이 확산화염쪽으로 이동하면서 OH 라디칼을 공유하면서 공생하는 것을 볼 수 있다. Fig. 10에서 알 수 있듯이 상당한 양의 O가 정체점 근처에서 생성되어 확산화염 근처에서 소모되고 OH를 생성하면서 약한 화염에 OH를 공유하면서 약한 화염의 생존을 돕고 잇다는 것을 알 수 있다.
4. 결 론
CO-O2 화염에 대해 연료측에 H2O를 첨가한 경우에 대한 후류 상호작용하는 화염에 대한 연구로부터 다음과 같은 결론을 얻을 수 있었다.
1) CO-O2 예혼합 화염에 1% H2O를 첨가하여도 CO + 0.5O2 → CO2 반응으로부터 산화반응 경로가 CO + OH → CO2 + H로 바뀌면서 층류 화염전파속도는 5.3 cm/s로부터 급격히 증가하여 15% H2O 첨가에서 .151.7 cm/s까지 증가하여 화염 안정성을 급격히 증가시키게 된다.
2) 모든 조건에서 연료 루이스수와 유효 루이스수가 1보다 크기 때문에 열적 상호작용에 의한 영향보다는 주로 화학적 상호작용에 의해 후류 상호작용하게 된다. CO-O2 화염은 화염신장율이 23.5s-1만 되어도 모든 화염이 소화되지만 (1% H2O + CO)-O2 화염에서는 화염신장율이 2687 s-1가 되어야 모든 화염이 소화될 만큼 화염 안정성이 확장된다.
3) (1% H2O + CO)-O2 화염에서 희박-희박 화염에서는 O 라디칼의 생성과 소모가 커서 H2O + O → OH + OH 반응을 통해 OH를 활발히 생성하고 CO + OH → CO2 + H 산화반응 경로를 취하게 된다. 과농-과농 화염에서는 H 라디칼의 생성과 소모가 더 커서 H2O + H → OH + H2 반응을 통해 상대적으로 OH를 덜 생성되어 CO + OH → CO2 + H 산화반응 경로를 취하게 된다. 이러한 산화반응 경로에 의해 생성된 OH 라디칼의 양이 CO + OH → CO2 + H 반응에 참여하면서 화학적 상호 작용에 통해 화염 안정화에 기여하고 있음을 알 수 있다.