1. 서 론
2. 실험장치 및 수치해석의 경계조건
2.1. 실험장치
2.2. 수치해석의 경계조건
3. 결과 및 고찰
3.1. Propene 실험 결과
3.2. 축소 메커니즘의 검증
4. 결 론
1. 서 론
Propene은 propane, n-butane, n-heptane 및 iso-octane 등과 같은 높은 탄소수를 가지는 alkane 연료의 연소에서 매우 중요한 중간체로 알려져 있으며, 알킬 라디칼 분해 (alkyl radical decomposition)등에 의해 만들어진다[1]. 이러한 propene의 반응 메커니즘(kinetic mechanism)은 alkene 특유의 동역학 특성을 가지며, 고분자 연료의 전반적인 반응 메커니즘을 결정하는데 필수적이다. 또한, propene에서 H-atom abstraction 후에는 공명 안정화된 (resonantly stabilized) allyl radical이 형성되고 이 allylic 화학종들은 매연을 형성하는데 영향을 미치는 방향족(aromatic)과 다방향족 탄화수소들 (polyaromatic hydrocarbons)을 형성하는 것에 영향을 미친다.[1], [2], [3], [4], [5], [6] 여러 분야에서 사용되는 LPG는 다양한 탄화수소 연료의 혼합물이지만 주로 propane, propene, butane으로 이루어져 있고 적당한 온도와 압력조건에서 액체형태로 저장되기 때문에 천연 가스보다 높은 에너지 밀도를 가지는 장점이 있다. 또한 디젤 및 등유 사용을 대체하기 위해 LPG를 사용할 시 환경 및 경제적으로 이익을 만족할 수 있다. 즉, LPG를 구성하는 연료 중 하나인 propene의 연소 특성을 이해하는 것은 매우 중요하며, 이는 연소 시스템에서 오염 물질의 형성을 완화하기 위해서도 필요하다.[7]
Aramco 2.0 mechanism은 C1-C4 기반 탄화수소 및 함산소 연료(oxygenated fuel)의 화학반응과 열화학적 물성치(thermochemical properties)를 해석하기 위해 개발되었다[1], [8], [9], [10], [11], [12], [13].
이 반응식은 493개의 화학종과 2700개 이상의 반응단계로 이루어져 있다. 이렇게 많은 수의 화학종과 반응식은 실제 반응을 모사하는 정확성을 증가시키지만 수치해석 비용을 증가시키기 때문에 가능하다면 정확성을 확보하면서 적은 수의 화학종과 반응식을 이용하는 것이 효율적이다. 하지만, 너무 많은 수의 화학종과 반응식을 줄일 경우 정확도가 떨어지기 때문에 적당한 축소 메커니즘 (reduced mechanism)을 만드는 것이 필요하다. 국내에서 축소 메커니즘에 대한 연구는 Lee 및 Hur 등에 의해 발표된 고압조건에서 메탄/Air 화염의 축소반응 메커니즘과 methyl butanoate의 상세 화학 반응 메커니즘 자동 축소를 통한 기초반응 메커니즘 생성 및 검증에 대한 연구 등이 있다[14], [15], [16]. 또한 최근 국내에서 메커니즘 검증 장치인 shock tube에 대한 수치해석연구가 진행되기도 하였다[17].
본 연구에서는 Aramco 2.0 mechanism의 적절한 축소 메커니즘을 만들기 위해 path flux analysis[18], [19]을 수행하였다. 또한, 축소된 메커니즘의 검증을 위해 점화지연시간 계산과 plug flow reactor 수치해석을 수행하였다.
실험의 경우, propene의 산화반응특성을 파악하기 위해 층류 유동반응기를 이용하였다. 반응기는 유동의 특성에 따라 크게, 층류반응기, 난류반응기 그리고 jet-stirred 반응기 등으로 구분할 수 있다. 유동 반응기는 체류시간을 변경하면서 화학종의 농도를 측정할 수 있으며, 다른 방법으로는 체류시간을 고정하고 온도에 따른 화학종 농도를 측정하기도 한다.
본 연구에서는 propene의 시간 변화에 따른 화학 반응특성을 파악하였다. 또한, 축소 메커니즘을 유도하고 검증하고자 한다.
2. 실험장치 및 수치해석의 경계조건
2.1. 실험장치
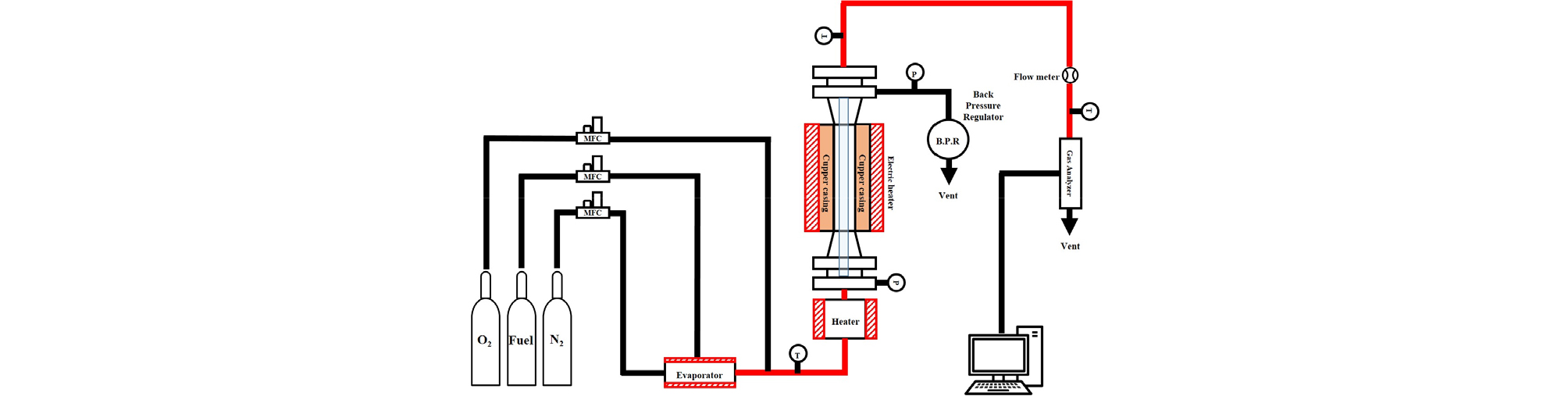
Fig. 1은 본 연구의 실험장치에 대한 개략도이다. 명칭은 laminar flow reactor (LFR)이며, 크게 3부분으로 구분할 수 있다.
첫 번째 영역은 연료와 산화제 그리고 희석가스를 공급하는 공급부로, 여기에는 연료 및 산화제(O2) 그리고 희석가스(N2, Ar, He 등)가 MFC를 통해 조절되어 공급된다. 두 번째 영역은 반응기가 설치되어 있는 반응부로, 혼합가스 (연료, 산화제, 희석가스)가 안정화된 반응기 안으로 들어가 반응이 일어나는 영역이다. 마지막 영역은 측정부로 반응이 일어난 가스의 일부를 sample port를 통해 채취한 후 가스분석기 또는 가스크로마토그래피 (GC)를 통해서 측정하는 영역이다.
Fig. 1을 보면 연료와 희석가스가 먼저 혼합이 된 후에 산화제와 혼합되어 반응기로 들어간다. 또한, 반응기 전단에는 heater가 장착되어 있어 혼합가스가 반응기에 들어가기 전에 빠른 속도로 설정 온도에 도달할 수 있도록 하며, 반응기 외부에서도 heater를 장착하여 설정 온도를 만들어 준다. 반응기 내부에는 쿼츠 덕트가 장착되어 있고 이 안쪽으로 상하로 이동이 가능한 샘플프로브가 설치되어 있다.
이 샘플프로브의 위치를 변경하면 체류시간을 변경할 수 있으며, 본 실험에서도 샘플프로브를 위에서 아래 방향으로 이동시켜가며 화학종 (O2, CO, CO2)의 농도를 측정하였다.
층류 유동반응기 실험의 압력 조건은 6 atm 이며, 온도는 968K이다. 연료인 propene은 0.33%, O2 2.1% 이며 희석가스로는 질소(N2)를 사용하였고 당량비는 0.707 조건에서 실험을 수행하였다.
2.2. 수치해석의 경계조건
층류 유동반응기 실험결과를 검증하기 위해 Aramco 2.0 상세반응 메커니즘을 적용하여 plug flow reactor 수치해석을 수행하였다. 수치해석 조건을 Table 1에 나타내었다. 또한, Aramco 2.0 메커니즘을 축소하기 위해 path flux analysis (PFA)[18], [19]를 수행하였다. 메커니즘을 축소시키는 도구는 여러 가지가 있지만 PFA는 여러 반응 경로에서 화학종의 형성 및 소모 플럭스를 분석하여 중요한 반응 경로를 남기는 방식으로 메커니즘의 반응식과 화학종을 축소하는 방법으로 Ju 등이 제안하였다[16], [17]. 또한, PFA 방법은 앞서 말한 것과 같이 화학종의 소모플럭스를 계산하기 때문에 오직 상세 화학 반응 기구를 이용하는 직접관계그래프법(DRG)보다 신뢰도가 높다[18].
Table 1. Simulation condition of plug flow reactor
| Boundary conditions | |
| Pressure (atm) | 6 |
| Temperature (K) | 968 |
| Equivalent ratio | 0.707 |
| Residence time (s) | 0.134~1.4 |
| Oxidizer | O2 |
| Fuel (%) | 0.33 |
축소 메커니즘의 검증은 두 가지에 대해 각각 진행하였다. 즉, Aramco 2.0 상세반응 메커니즘을 이용한 점화지연시간 수치해석 및 plug flow reactor 수치해석과 축소 메카니즘의 결과를 각각 비교하는 방식으로 진행하였다. 점화지연시간 수치해석의 조건은 Table 2에 나타내었다.
Table 2. Simulation condition of ignition delay time
| Boundary conditions | |
| Pressure (atm) | 20 |
| Temperature (K) | 600~1025 |
| Equivalent ratio | 0.707 |
| Oxidizer | Air |
| Fuel (%) | 3.20 |
3. 결과 및 고찰
3.1. Propene 실험 결과
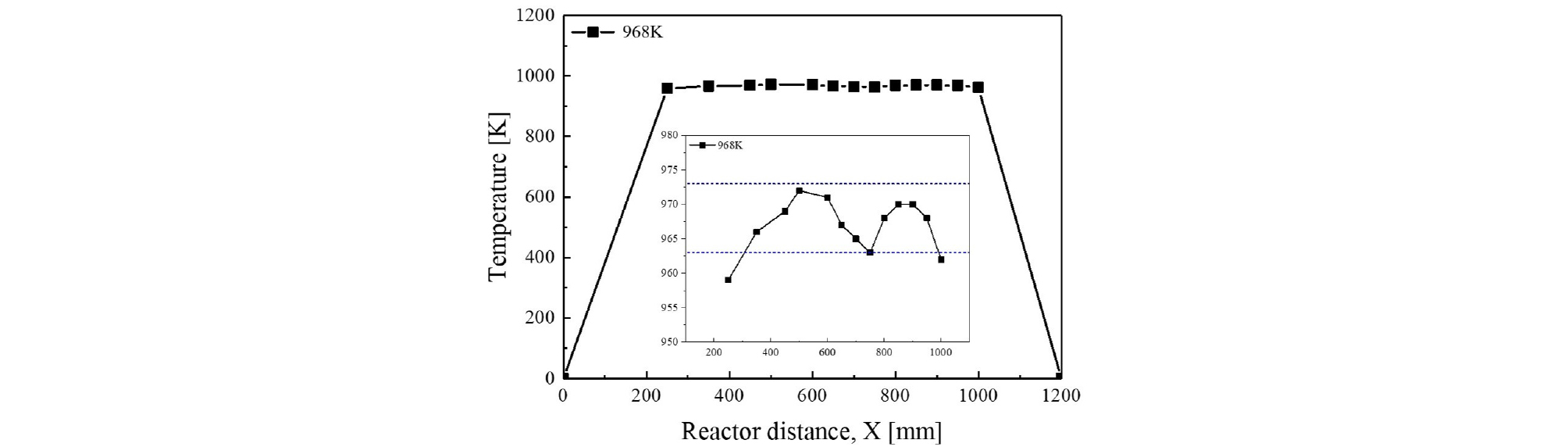
유동 반응기 실험의 경우 균일한 온도 조건에서 이루어져야하기 때문에 축 방향으로 온도의 균일성이 만족되어야 한다. 하지만 실제 실험조건에서는 균일한 온도를 만족하기란 쉽지 않고, 때문에 어느 정도 온도 편차를 허용하는데 ±5 K 정도의 온도가 허용되고 있다.
Fig. 2에 6 atm, 968 K에서 수행한 온도 균일성 실험결과를 나타내었다. 그림에서 점선 부분은 ±5 K을 나타낸 부분이다. 전반적으로 300 mm 이후부터는 설정 온도인 968 K 근처에 도달하고 350 mm 이후부터 1000 mm 이하까지 허용온도 범위 안에 들어간다. 이러한 결과를 토대로 약 350 mm부터 950 mm 까지는 균일한 온도를 갖는 것으로 판단할 수 있다.
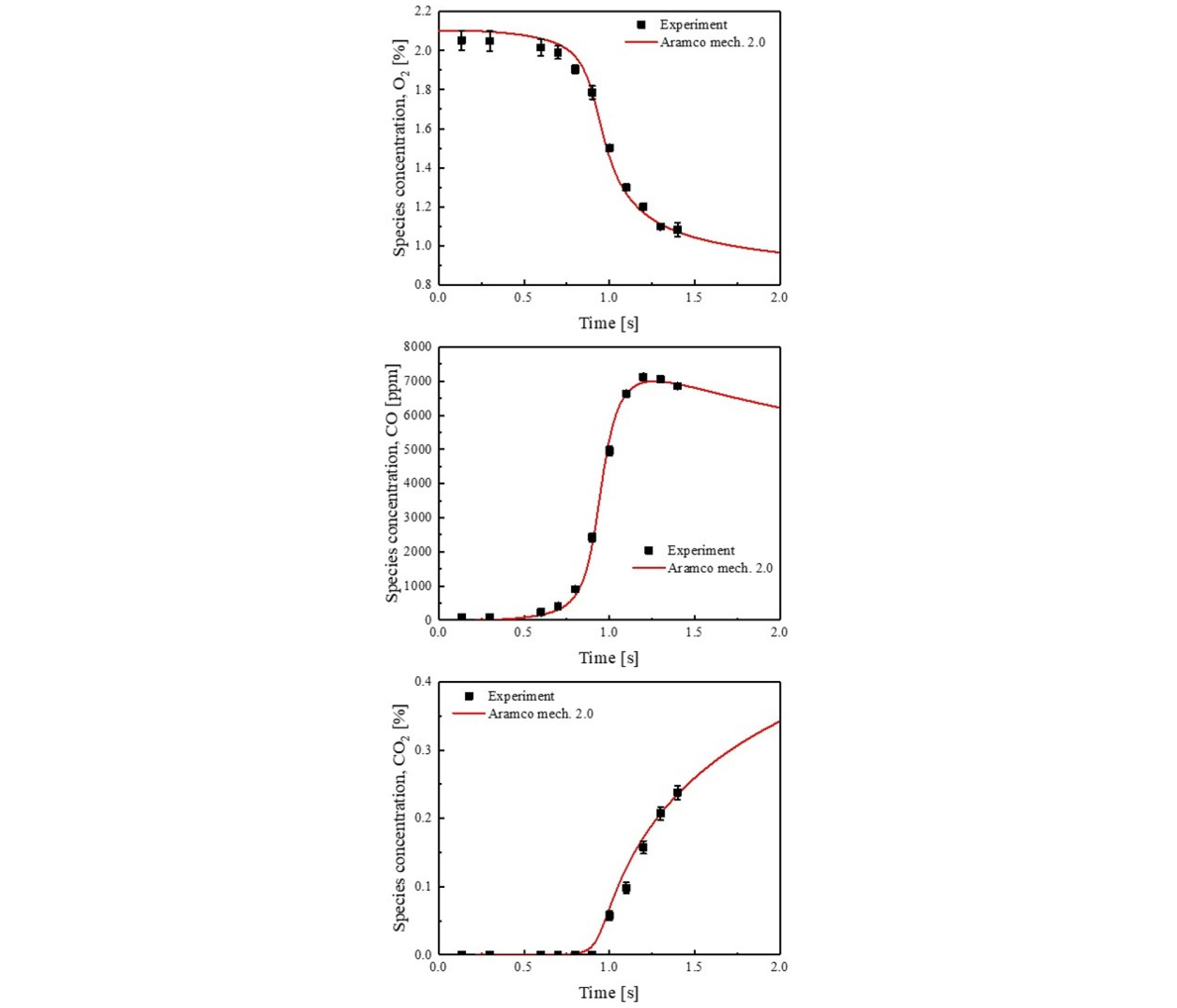
실험결과와 plug flow reactor 수치해석 결과를 Fig. 3에 나타내었다. 여기에서 사각형 점은 실험에서 측정한 농도 결과이며 붉은색 실선은 Aramco 2.0 상세반응 메커니즘을 이용한 수치해석 결과이다.
실험결과에서 체류시간을 구하기 위해서 공급한 유량과 운전 압력조건에서의 평균 유속을 구하였고, 이 평균 유속과 샘플프로브의 위치를 통해 체류시간을 계산하였다.
Fig. 3에서 O2 농도 실험결과를 보면 약 0.5~0.8 s 정도까지는 약하게 반응이 일어나다가 0.9 s 이후부터 급격하게 반응이 진행되는 것을 볼 수 있다. 이와 동일하게 CO 또한 0.5 s~0.8 s 까지는 천천히 농도가 증가하다가 0.9 s 이후부터 급격하게 농도가 상승한다. 하지만 약 1.2 s 이후에는 농도가 점차 감소하는 결과를 보여준다.
CO2의 경우 0.9 s 이하에서는 농도의 변화를 거의 보이지 않다가 1.0 s 이후에 급격하게 농도가 변화하며 꾸준히 증가하는 결과를 보여준다.
이러한 반응특성은 탄화수소 계열 연료에서 보이는 반응특성으로 처음에 연료가 O atom 또는 H atom의 공격을 받아 분해되면서 CO가 증가한다. 때문에 O2의 감소와 CO의 증가는 매우 유사한 시간동안 일어난다. 하지만 일정 시간이 흐른 이후에는 CO의 산화로 인해 CO가 점차 감소하게 되고 CO2가 증가하게 된다. 즉, 실험에서 1.2 s 이후에 CO의 산화반응이 활발하게 일어나면서 CO2가 증가하고 CO가 감소하는 것이다.
Fig. 3의 수치해석 결과는 실험과 비교하기 위해서 +0.216s time shift를 적용하였다. Time shift는 열손실등의 요인으로 인해 반응시작이 지연되는 실험과 수치해석을 비교할 수 있도록 교정하는 방법으로, 여기에서는 실험결과를 고정하고 수치해석 결과를 오른쪽으로 +0.216 s 이동시켰다. 또한, 메커니즘 검증 시 수치해석결과와 실험결과의 비교는 화학종 농도의 기울기로 이루어졌고, time shift 적용후, 동일시각에서 수치해석과 실험 결과간 농도 오차를 비교하였다.
수치해석 결과는 앞에서 서술한 것과 같이 붉은색 실선으로 나타내었다. 그림에서 O2 결과를 보면 실험과 동일하게 일정 체류시간까지는 반응이 미미하게 일어나다가 급격하게 반응이 일어나며 이와 유사한 시간 영역에서 CO 농도의 급격한 증가가 나타난다. 또한 체류 시간 이후에는 CO 농도는 감소하게 된다. CO2 결과 또한 실험과 매우 유사한 경향성을 보인다.
실험과 수치해석의 오차를 비교하였을 때, O2의 경우 최대 3.25%, CO 5.51%, CO2 6.91%로 10% 이하의 낮은 오차를 보여주었다. 이러한 결과는 본 실험에서 채택한 층류 유동반응기가 정상적으로 작동하고 있음을 보여준다.
Fig. 4에 참고문헌[1]에 나와 있는 실험결과와 수치해석 결과를 나타내었다. 참고문헌에서 사용된 반응기는 variable pressure flow reactor (VPFR)로 제작된 난류 유동반응기이다. 이 반응기는 20 bar, 1200 K, 100~5000 ms 범위에서 사용가능하다. VPFR은 검증된 난류 유동반응기이며, Dryer et al. 등은 이 반응기를 통해 기체연료 및 액체연료, jet fuel 등과 같은 다양한 연료의 반응에 대해 연구를 수행하였다. 참고문헌[1]의 실험조건은 층류유동반응기의 실험조건과 동일하고 사용한 메커니즘도 Aramco 2.0으로 동일하다. LFR과 VPFR은 유동 특성에 서로 차이가 있음에도 불구하고 동일한 실험조건과 동일한 메커니즘을 이용하였기 때문에 간접적인 비교가 가능하다고 판단된다. 이 경우, 전 구간에서의 농도 오차를 고려하여 참고문헌의 결과에 time shift를 적용하지 않았다. 비교결과, LFR은 앞에서 서술한 것과 같이 10% 이내의 오차를 보였고, VPFR 실험의 경우 O2 16.67%, CO 88%, CO2 70.3% 정도의 오차를 보였다.
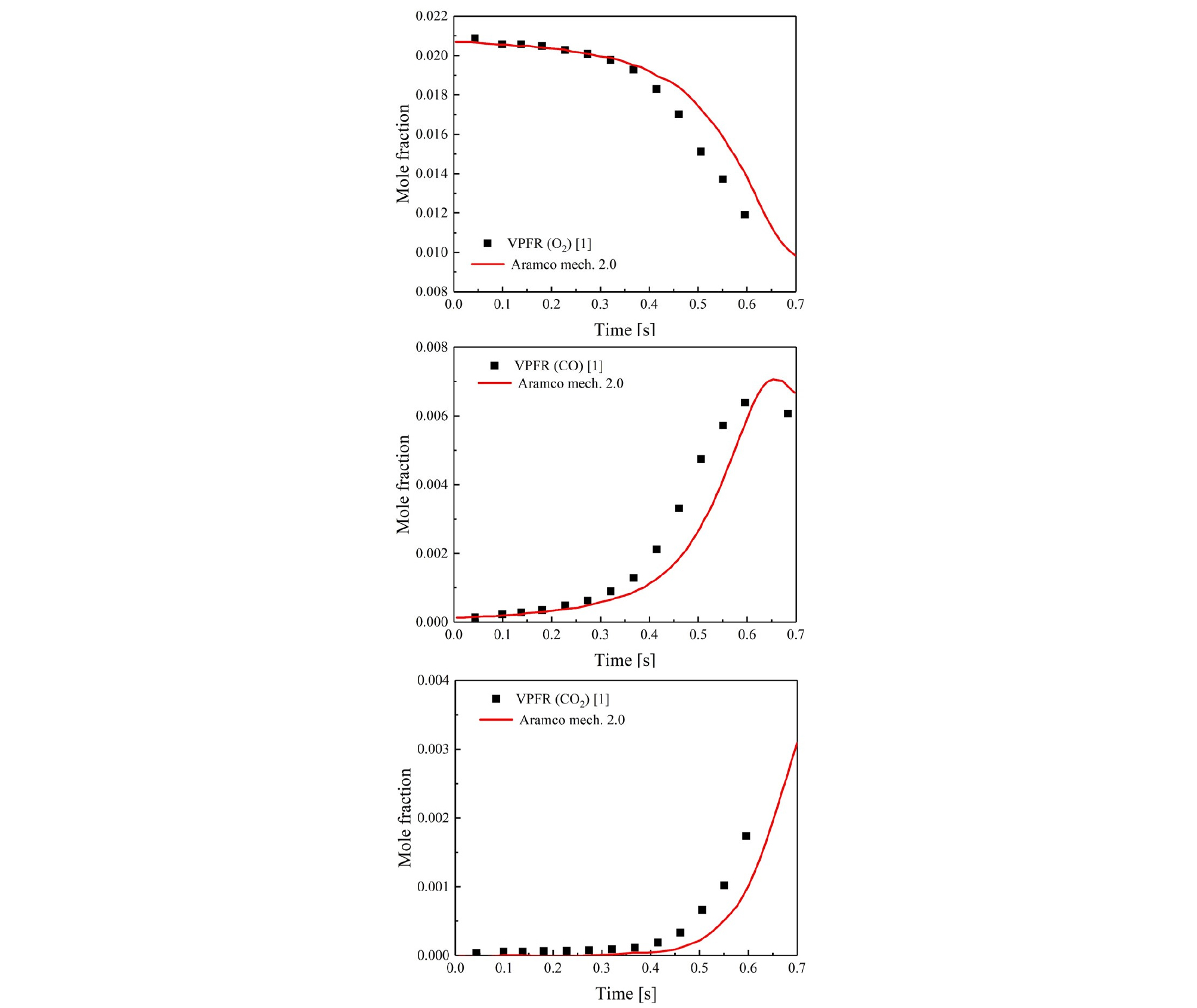
Fig. 4.
Propene oxidation data of VPFR[1] (variable pressure flow reactor) for same experimental condition of LFR.
이러한 간접적인 비교를 바탕으로 세본 층류 유동 반응기가 잘 작동하고 충분히 산화 과정 측정에 사용될 수 있는 장치라고 판단된다.
3.2. 축소 메커니즘의 검증
Aramco 2.0 메커니즘은 앞에서 서술한 것과 같이 매우 많은 화학종과 반응식으로 이루어져 있다. 이러한 반응식을 2D 또는 3D 수치해석에 적용할 경우 그 비용이 매우 크기 때문에 적절하게 줄여서 사용하는 것이 효율적이다.
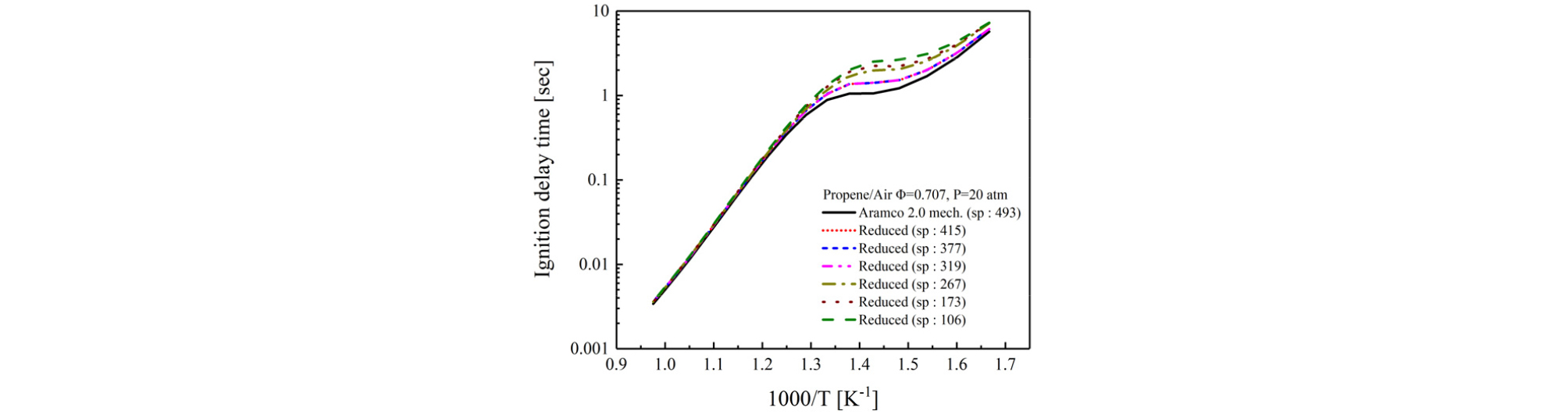
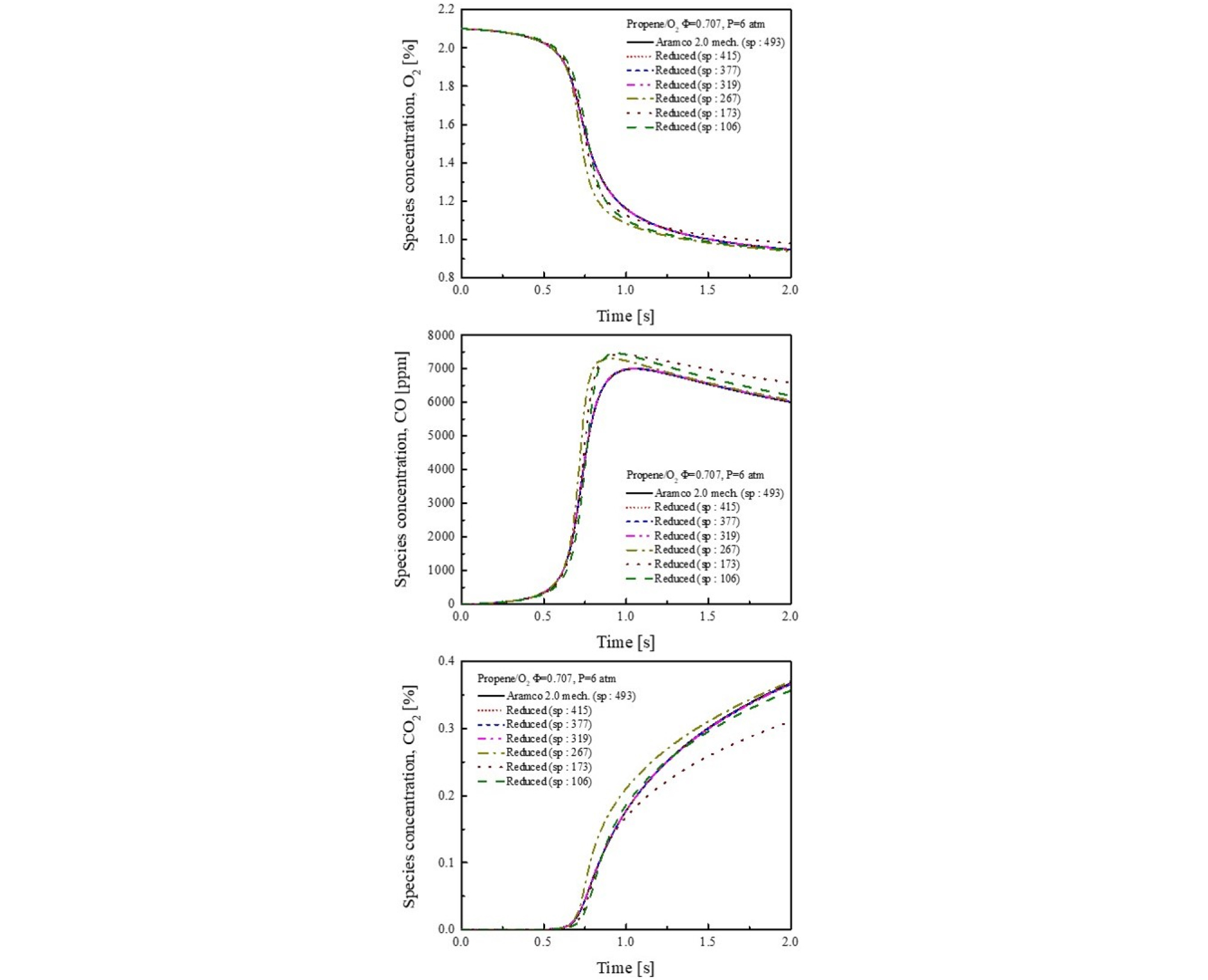
Path flux analysis (PFA)[14], [15]는 메커니즘을 줄이는 방법 중에 하나로 화학반응식의 여러 경로 중 화학종의 생성 또는 소모 플럭스를 계산하여 화학종과 반응식을 축소한다. 여기에서는 화학종을 최대 106개까지 감소시켜 점화지연시간과 plug flow reactor 수치해석을 수행하였고, 상세반응 메커니즘과 비교하였다.
Fig. 5에 점화지연시간 수치해석 결과를 나타내었다. 그림을 보면 화학종의 수가 감소할수록 650~800 K 사이에서 오차가 점점 증가하는 것을 알 수 있다. 여기에서 화학종이 106개 일 때, 700 K에서 최대 오차 138%를 보인다. 하지만 고온 영역인 900 K 에서는 모든 축소 메커니즘에서 10% 미만의 낮은 오차를 보인다.
축소 메카니즘의 화학종 수가 415개에서 319개 까지는 동일한 수치해석 결과를 보였고 이때 상세반응과 오차는 최대 33.41%로 나타나지만 이는 700 K 저온에서 나타는 오차로 아직 저온에서의 반응 메커니즘이 부족하기 때문에 나타나는 결과라고 판단할 수 있다.
여기에서 주목할 점은 축소 메커니즘의 경우 화학종의 수가 415개에서 319개까지 동일한 결과를 보였다는 것과 고온에서는 모든 축소 메커니즘간의 오차가 낮다는 것이다.
이러한 결과를 바탕으로 968 K 실험에서는 가장 적은 화학종을 가지는 106개 화학종의 메커니즘을 사용하여 수치해석과 실험을 비교해도 무관할 것으로 보인다. 유동반응기내 산화과정에서의 적용성 검증을 위해, 축소반응 메커니즘을 사용한 plug flow reactor 수치해석을 수행하여 그 결과를 Fig. 6에 나타내었다. 106개의 화학종을 사용한 plug flow reactor 수치해석과 상세반응 수치해석 결과가 매우 상이하게 나타났다.
Fig. 6으로부터 알 수 있듯이 점화지연시간 수치해석과 동일하게 415~319개에서 축소모델 수치해석결과와 상세반응 수치해석결과가 매우 유사하게 나타나는 것을 알 수 있다.
하지만, 화학종 수가 319개 이하로 줄어들 경우 조금씩 농도간 오차를 보인다. O2 농도를 보면 0.8 s 위치에서 상세반응 메커니즘 보다 O2의 소모가 많아지고 이에 따라 CO의 농도가 증가하면서 상세반응 보다 높은 농도 결과를 보인다.
또한, 화학종 수가 173개 일 때 CO2 농도는 매우 큰 오차를 보인다. 이때의 오차는 화학종 수가 106개 일 때보다 크다. 이러한 결과를 통해 많은 화학종 수를 포함하는 메커니즘이 정확한 예측을 하는 것이 아니며, 중요한 반응식을 포함하는 것이 필요함을 확인할 수 있다.
앞에서 설명한 것과 같이 고온에서의 점화지연 수치해석 결과는 모든 축소 메커니즘에서 약 10% 이내의 작은 오차를 보였지만 plug flow reactor 수치해석에서는 큰 차이를 보인다.
따라서, 축소 메커니즘을 검증할 때는 점화지연 수치해석이나 plug flow reactor 수치해석 하나만 적용하여 검증하는 것이 아니라 최소 2개를 모두 고려하여 적절한 축소 메커니즘을 만들어야 할 것이다.
현재까지 점화지연시간 수치해석과 plug flow reactor 수치해석 결과로부터 적절한 축소 메커니즘은 화학종 수가 319개인 것으로 파악하였다. 화학종수와 반응단계수가 적을수록 계산 시간이 감소하기 때문에 추가로 축약시키는 것이 유익하지만 본 연구에서는 전반적으로 동일한 반응 특성을 유지하면서 메커니즘을 축소하였다. 이때의 반응식은 약 2086개로 기존의 상세반응 메커니즘의 반응식 보다 약 23% 감소하였다.
2D 또는 3D 계산을 진행할 때 23% 축소된 메커니즘을 사용할 경우 기존 상세반응 메커니즘을 사용할 때에 비하여 계산 시간을 절약할 수 있을 것이며 계산결과의 정확도는 상세반응을 이용한 계산 결과와 유사할 것으로 판단된다. 온도 및 압력 구간을 제한한다면 추가로 더 작은 메카니즘으로 축약할 수 있을 것이다.
4. 결 론
Propene의 반응특성을 층류 유동반응기를 이용하여 계측하였다. 측정한 화학종은 O2, CO, CO2로 0.134~1.4 s 까지 체류시간을 변경하면서 측정하였고, 검증된 메커니즘인 Aramco 2.0 상세반응 메커니즘과 비교하였다. 실험과 수치해석 간 농도차이는 O2 3.25%, CO 5.51%, CO2 6.91%로 나타났으며 이러한 결과를 토대로 층류 유동반응기가 충분히 그 기능을 수행할 수 있다고 판단된다.
수치해석 계산 시간의 단축을 위해 메커니즘 축소를 시도하였고 이를 위해 path flux analysis를 수행하였다. 축소된 메커니즘은 점화지연시간 수치해석과 plug flow reactor 수치해석 결과를 통해 검증하였다. 검증결과 화학종이 319개 이하로 감소할 경우 두 수치해석에서 모두 오차가 증가하는 것을 확인하였다. 따라서, 해당 조건에서 정확한 농도 예측을 위해서는 최소한 319개 이상의 화학종을 가지는 축소 메커니즘을 이용해야 할 것이다.